Emostasi e test della coagulazione
- Disciplina: Ematologia, Immunologia, Diagnostica di laboratorio
- Specie: Cane e Gatto
L’emostasi nasce da un’interazione equilibrata tra cellule del sangue, sistema vascolare, proteine plasmatiche e sostanze a basso peso molecolare. L’organismo mantiene tale sistema in un continuo equilibrio affinché il sangue possa circolare liberamente senza incorrere in cambiamenti caratterizzati da un’eccesiva densità (trombosi) o fluidità (emorragia).
UNA PERFETTA EMOSTASI SIGNIFICA: NO EMORRAGIA E NO TROMBOSI
Per meglio comprendere la sequenza di tali eventi il processo emostatico viene didatticamente suddiviso in:
- emostasi primaria
- emostasi secondaria
- emostasi terziaria.
EMOSTASI PRIMARIA
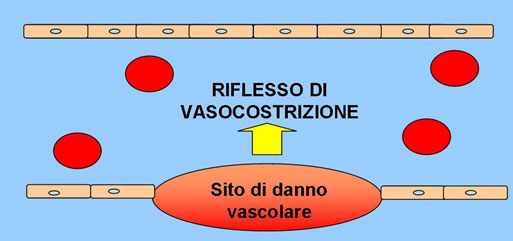
L’emostasi primaria comprende una fase vascolare e una piastrinica. La prima interviene a seguito della perdita di integrità vascolare, con esposizione del collagene sub-endoteliale, che comporta un processo immediato e temporaneo di VASOCOSTRIZIONE e riduzione del flusso ematico. Tale processo multifattoriale sembra essere legato a stimoli neurogenici e a liberazione di sostanze vasocostrittrici ad azione locale come il trombossano A2, liberato dalle piastrine attivate (Fig.1).
La vasocostrizione altera il normale flusso laminare che caratterizza la circolazione ematica creando un flusso turbolento. Grazie al flusso turbolento le piastrine possono venire più facilmente a contatto con il collagene sub-endoteliale, a cui aderiscono (FASE DI ADESIONE PIASTRINICA) (Fig.2). Patologie che alterano l’omeostasi, come vasculiti, possono predisporre il paziente a patologie emostatiche.
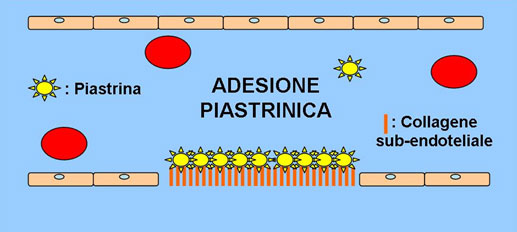
Fig. 2. Fase di adesione piastrinica
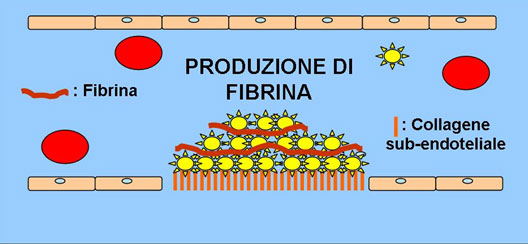
L’adesione è resa possibile grazie a recettori glicoproteici posti sulla membrana delle piastrine. In particolar modo, il legame tra il fattore di von Willebrand (vWF) presente a livello endoteliale in forma filamentosa e la GP Ib-V-IX creano un legame tra il sub-endotelio e le piastrine. Tale processo determina l’attivazione delle piastrine, con conseguente alterazione della conformazione strutturale e degranulazione, quest’ultima caratterizzata dalla liberazione di mediatori chimici (ADP e trombossano A2) in grado di richiamare altre piastrine nel sito di lesione vascolare per promuovere la formazione di un tappo piastrinico (Fig.3). Nello specifico la GPIIb/IIIa rende possibile il legame tra le singole piastrine. Quest’ultima parte è detta fase di aggregazione.
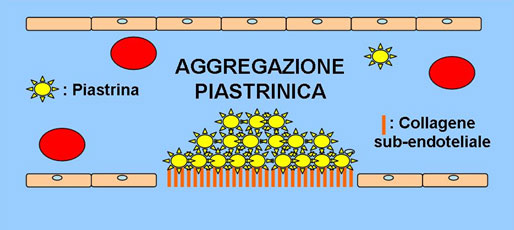
Fig. 3. Fase di aggregazione piastrinica
Benché il tappo piastrinico sia cospicuo da un punto di vista volumetrico, presenta una certa instabilità e permette l’emostasi solo di vasi di dimensioni ridotte. La ripresa di un normale flusso sanguigno porterebbe inevitabilmente alla rimozione del tappo piastrinico se non intervenisse il consolidamento dello stesso mediante la formazione di fibrina, il quale introduce l’emostasi secondaria (Fig. 4).
EMOSTASI SECONDARIA
La teoria basata sul modello a cascata prevede l’attivazione di proteine procoagulanti inattive (zimogeni), che, attivandosi a cascata producono come evento terminale la produzione di fibrina insolubile. Questa fibrina, come una rete, stabilizza in modo permanente il coagulo piastrinico.
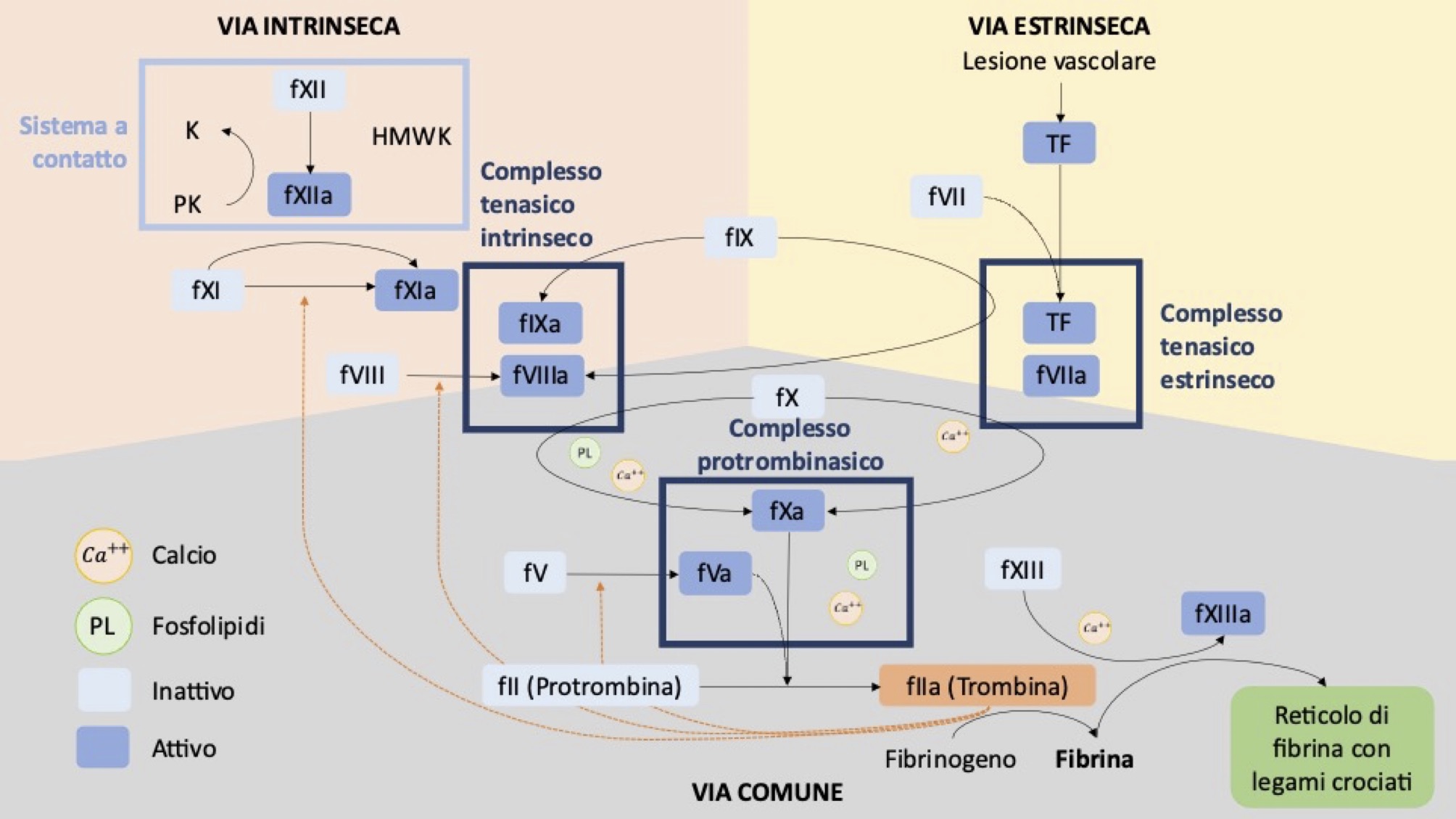
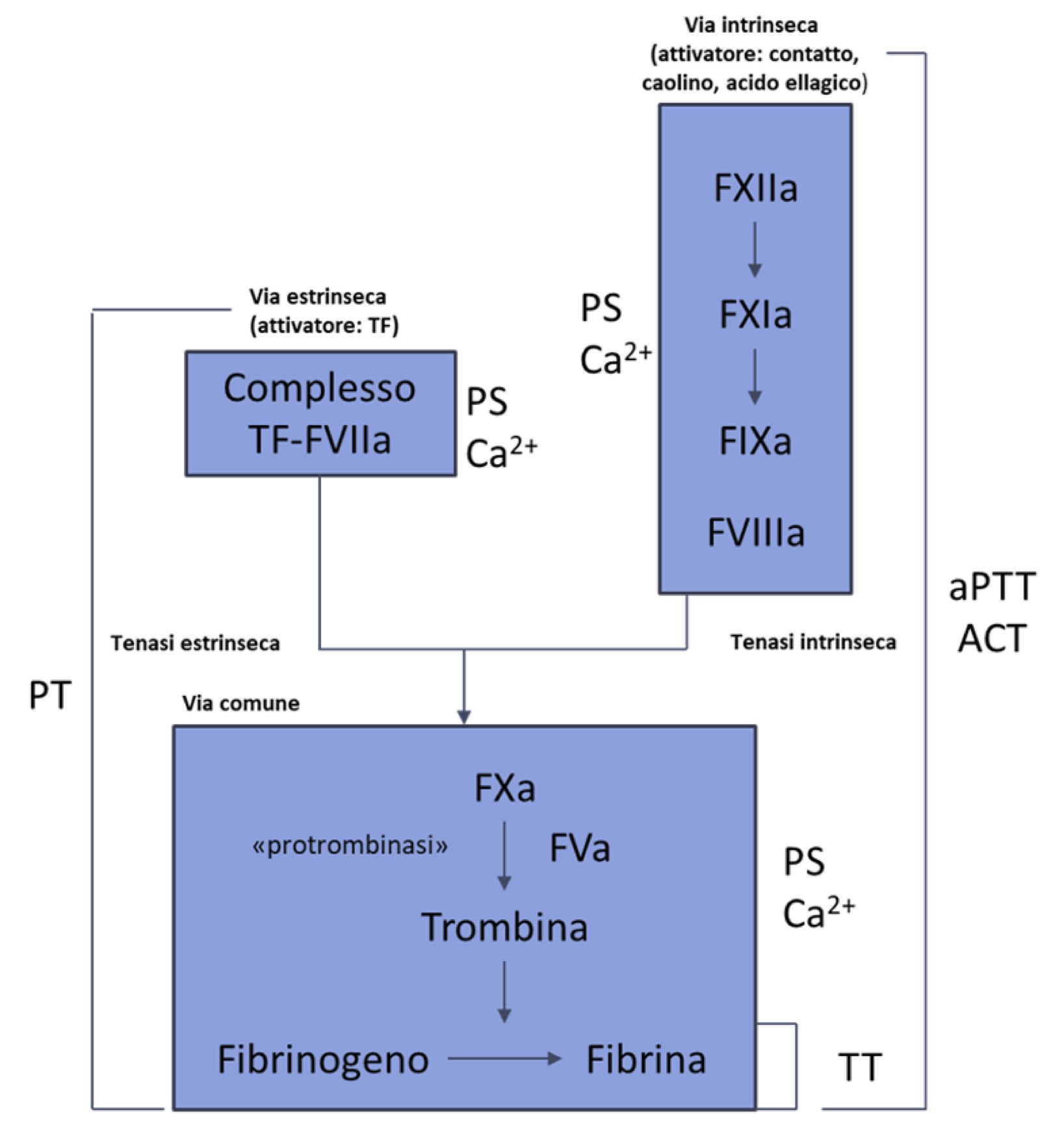
Tradizionalmente la cascata coagulativa è divisa in via intrinseca, estrinseca e comune (Fig. 5a).
La via intrinseca viene attivata dal contatto con il collagene sub-endoteliale, e le proteine coinvolte nella fase iniziale sono costituite dal chininogeno ad alto peso molecolare (HWMK), che si complessa con la precallicreina (PK) e il fattore XII (fattore di Hageman, fXII). Successivamente a questa complessazione, avviene l’attivazione del fattore XII, che si trasforma in proteasi attiva (XIIa). Questa proteasi attiva catalizza a sua volta la produzione di callicreina dalla PK, aumentando la produzione del fattore XIIa (processo autoamplificante) e del fattore XIa. Il fattore XIa interviene poi nell’attivazione (proteasi) di altre proteine pro-coagulanti. Tale processo nei test di laboratorio, viene attivato dal contatto con una superficie carica negativamente, come il vetro, la plastica o la sabbia di diatomee.
Ricerche recenti hanno evidenziato che, in vivo, l’attivazione della via intrinseca sembra essere scatenata dal polifosfato inorganico, una molecola liberata da piastrine attivate e da alcuni batteri. Ciò suggerisce un ruolo del fXII di ponte tra la fase piastrinica e quella plasmatica, nonché tra infiammazione e coagulazione.
La produzione del fattore XIa genera a sua volta una reazione a cascata, portando alla formazione del fattore IXa, che attiva e complessa il cofattore VIII insieme al calcio ione (Ca2+) e i fosfolipidi piastrinici (PL). A questo punto, si ha la trasformazione del fattore X (fattore di Stuart) nella sua forma attiva (fXa), che dà inizio alla via comune. Il processo di attivazione del fattore X a opera del fIXa viene accelerato di migliaia di volte in presenza del suo cofattore VIIIa, formando il complesso fIXa:fVIIIa, noto come complesso tenasico intrinseco.
FXII, PK e HWMK fanno parte del sistema a contatto. Queste proteine, apparentemente, non svolgono un ruolo nell’emostasi fisiologica. Infatti, nonostante carenze di questi fattori determinino un prolungamento dell’aPTT, nessun paziente manifesta una maggiore tendenza al sanguinamento. Esse invece potrebbero essere implicate nei processi protrombotici e immunitari.
La via estrinseca è ad oggi considerata la principale via di attivazione della coagulazione in vivo. Il fattore VII (proconvertina) forma un complesso con il fattore tissutale (TF), una glicoproteina di membrana presente in molte cellule extra-vascolari come fibroblasti, cellule muscolari lisce e cheratinociti. Il TF viene esposto a seguito di danni vascolari. Studi recenti hanno osservato che il TF può essere espresso anche da cellule endovascolari, come piastrine, monociti, neutrofili e cellule endoteliali, a causa di stimoli come citochine, virus e endotossine. Questo può attivare la via estrinseca anche in assenza di lesioni vascolari.
Quando il fVII entra in contatto con il TF, si attiva in fVIIa e, in presenza di Ca2+ e fosfolipidi, forma il complesso TF:VIIa, noto come complesso tenasico estrinseco. Questo complesso a sua volta attiva il fattore X con attivazione della via comune.
La via comune, attivata sia dalla intrinseca che dalla estrinseca, ha come obiettivo finale l’attivazione del fX ad opera dei due complessi tenasici, portando alla produzione di una piccola quantità di trombina. La trombina genera fibrina insolubile a seguito del distacco dei fibrinopeptidi A e B (FPA, FPB) dalle catene α e β della molecola di fibrinogeno. Tale processo avviene in presenza di fosfolipidi, Ca2+, e del cofattore V attivato (fVa), costituendo il complesso fXa:fVa, noto come complesso protrombinasico.
Successivamente, i monomeri di fibrina insolubili vanno incontro ad un processo di polimerizzazione e stabilizzazione, coadiuvato dal fXIII (fattore di Laki-Lorand).
Figura 5a Modello della cascata coagulativa (modificata da Pesaresi 2020)
Dato che il processo coagulativo è un evento autoamplificante, la trombina è in grado di attivare diversi fattori della coagulazione a monte della cascata coagulativa. Tuttavia, per evitare la formazione di un trombo occlusivo in sede vascolare e per consentire la rimozione del coagulo una volta riparato il danno tissutale, è necessario un meccanismo di controllo per la dissoluzione del trombo stesso (emostasi terziaria).
EMOSTASI TERZIARIA
L’emostasi terziaria o fibrinolisi viene attivata dalla produzione di un attivatore del plasminogeno (t-PA) da parte delle cellule endoteliali contigue alla sede della lesione. Tale enzima converte il plasminogeno in plasmina, proteina dotata di un elevato potere proteolitico, che se pur non selettivo, confina la sua attività principalmente nel coagulo. Altri enzimi ad attività fibrinolitica sono l’attivatore del plasminogeno di origine urinaria (u-PA) e la Streptochinasi di origine batterica.
Principali anticoagulanti endogeni
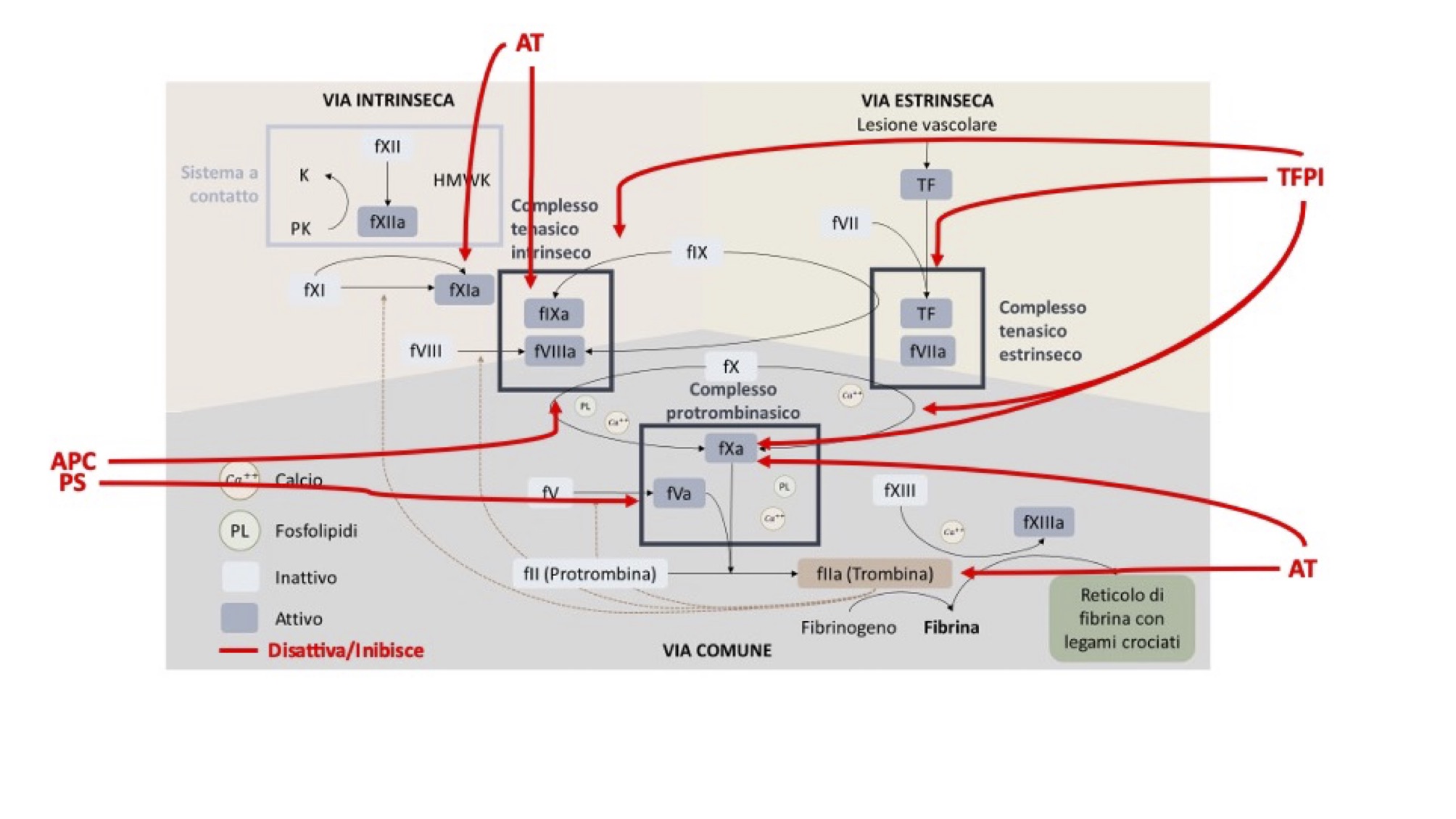
È estremamente importante che i processi emostatici si attivino solo in presenza di una lesione vascolare e rimangano confinati in quella sede. Pertanto, l’organismo presenta strutture e molecole anticoagulanti. Tra queste possiamo elencare: l’endotelio, l’inibitore della via del fattore tissutale (TFPI), l’antitrombina (AT) e la proteina C attivata/proteina S (APC/PS) (Fig. 5b).
Figura 5b Azione degli anticoagulanti esogeni (modificata da Pesaresi 2020)
L’integrità endoteliale rappresenta il primo ostacolo all’instaurarsi dei processi emostatici. In condizioni di normalità, è rivestito dal glicocalice, uno strato di muco-polisaccaridi che non permette l’adesione piastrinica e dei fattori della coagulazione. Inoltre, le cellule endoteliali producono molecole con azione anticoagulante come prostacicline, ossido nitrico ed ecto-ADPasi, le quali impediscono le diverse fasi che portano all’attivazione e all’aggregazione piastrinica.
Gli anticoagulanti endogeni sono molecole che limitano il propagarsi della cascata coagulativa, agendo attraverso attività proteolitica o chelante sui fattori della coagulazione attivati. I tre principali anticoagulanti sanguigni sono: l’inibitore della via della via del fattore tissutale (TFPI), l’antitrombina (AT) e la proteina C (PC).
Il TFPI viene principalmente prodotto dalle cellule endoteliali e svolge la sua azione su più livelli: promuove la disattivazione del fXa, interferisce con il complesso tenasico estrinseco (TF-fVIIa), riduce l’attivazione dei fattori IX e X.
L’AT, una glicoproteina di origine epatica, ha come principale funzione quella di legare e inattivare la trombina circolante. Inoltre, svolge la sua azione proteolitica su fattori della coagulazione attivati come il fXa, fIXa e fXIIa.
La PC è una proteina vitamina K-dipendente di origine epatica presente in circolo. Questa viene attivata in APC ad opera del complesso trombina:trombomodulina e dalla sola trombina. L’APC, in presenza di calcio, fosfolipidi e del suo cofattore, la PS, inattiva il fVa e il fVIIIa.
Modello cellulare della coagulazione
Questo modello appare essere maggiormente rappresentativo di quello che avviene in vivo, rispetto alla cascata coagulativa classica, la quale descrive meglio quello che avviene in vitro (nei test di laboratorio). Al centro di tale modello troviamo la componente cellulare, in particolar modo le piastrine, sulla cui superficie avvengono tutte le reazioni enzimatiche.
In tale modello tutti i processi vengono suddivisi in quattro fasi distinte: Iniziazione, Amplificazione, Propagazione e Terminazione.
Iniziazione I processi emostatici iniziano con l’esposizione del TF al flusso ematico, che porta all’attivazione della via estrinseca. Si ha interazione tra il TF e il fVIIa circolante con formazione del complesso tenasico estrinseco e conseguente attivazione del fXa e la produzione di piccole quantità di trombina.
Amplificazione La modesta quantità di trombina prodotta non è in grado di produrre un coagulo stabile, ma attiva le piastrine, il fVa, il fIIIa e il fXIa. Questi fattori si legano alla membrana delle piastrine attivate, diventando stabili.
Propagazione Il fXIa attiva il fIXa, formando il complesso fIXa-fVIIIa con conseguente produzione di fXa. Successivamente, si forma il complesso protrombinasico (fXa:fVa) che genera grandi quantità di trombina, conducendo alla formazione di un coagulo stabile. Quest'ultimo processo coinvolge anche l'attivazione del fattore XIII.
Terminazione L’effetto degli anticoagulanti endogeni prevale sui fattori della coagulazione e il processo emostatico cessa. Questa fase è di fondamentale importanza per evitare la diffusione sistemica del processo emostatico.
APPROCCIO CLINICO ALLE COAGULOPATIE
Le coagulopatie possono avere caratteristiche emorragiche e/o trombotiche. Al clinico compete di:
- riconoscere a fronte di una particolare sintomatologia clinica se la medesima sia ascrivibile ad una coagulopatia, sia essa acquisita o congenita
- comprendere quale fase del processo emostatico (fase primaria, secondaria o terziaria) risulti alterata
- scegliere il miglior protocollo diagnostico e terapeutico per perseguire la diagnosi e, quando possibile, la risoluzione clinica del problema.
I dati anamnestici e l’esame obiettivo risultano utili all’identificazione dei primi due punti. Ad esempio, la perdita ematica in soggetti giovani, di razza selezionata (es. Pastore tedesco) impone il sospetto di una coagulopatia congenita (es. Emofilia A). L’assunzione di farmaci (es. FANS, cumarinici, eparina) potrebbe giustificare un quadro emorragico. Alcune malattie, quali ad esempio una pancreatite, una neoplasia, una torsione gastrica, un colpo di calore, un’anemia emolitica immunomediata, possono complicarsi con una coagulazione intravascolare disseminata (DIC – disseminated intravascolar coagulation).
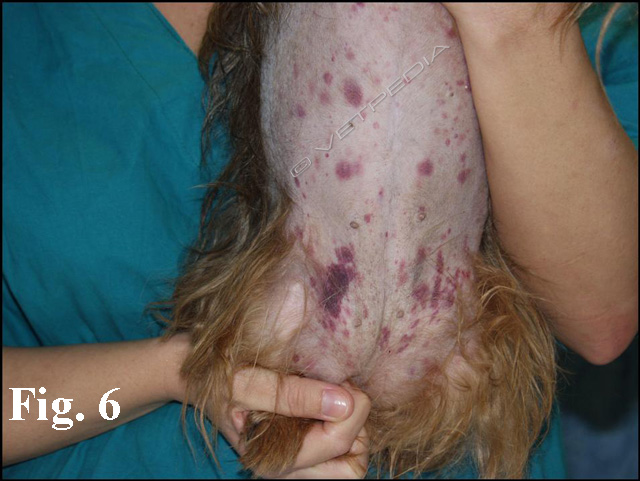
Sanguinamenti superficiali (petecchie, echimosi, epistassi) (Fig. 6) possono comunemente indicare un’alterazione emostatica primaria: la fibrina, infatti, che interviene grazie all’attivazione emostatica secondaria normofunzionante arresta il sanguinamento derivante da una piastrinopenia/patia. Alterazioni emostatiche secondarie si caratterizzano comunemente con versamenti emorragici cavitari (es. emotorace, emoaddome e emartro) o ematomi estesi. In questi casi la mancata produzione di fibrina non stabilizza il trombo piastrinico determinando una grave emorragia.
Benché i sanguinamenti di superficie (epistassi, ematemesi, ematuria e melena) siano più facilmente ascrivibili ad alterazioni emostatiche primarie, non è infrequente riscontrarle anche in quelle secondarie. In merito agli eventi trombotici, è fondamentale comprendere se si tratta di un evento generalizzato (DIC) o locale (es. tromboembolismo aortico da miocardiopatia felina).
TEST DI LABORATORIO PER VALUTAZIONE DELL’EMOSTASI
Il clinico dispone di diversi test di laboratorio che possono contribuire in modo significativo all’identificazione di una coagulopatia (Tab. 1).
| DIC | Insufficienza epatica | Avvelenamento da rodenticidi | Trombocitopenia | Malattia di von Willebrand | Emofilia A | Iperfibrinogenolisi primaria | |
| PLT | D/N | D/N/A | D/N | D | N | N | N/D |
| PFA-100® | N/A | N/A | N | A | A | N | N/D |
| PT | N/A | N/A | A | N | N | N | A/N |
| aPTT | A | N/A | A | N | N/A | A | A |
| FDPs | A | N/A | N/A | N | N | N | A |
| DIMERI D | A | N | N | N | N | N | N |
| Fibrinogeno | D/N/A | D/N/A | A/N | N/A | N | N | D |
| AT | D/N | D/N | N/D | N | N | N | N/D |
Tab. 1. Schema riassuntivo delle alterazioni di laboratorio in corso di comuni coagulopatie. (Legenda: N= normale; D= diminuito; A= aumentato).
Prelievo del campione Un corretto prelievo, la scelta di un appropriato anticoagulante e un’adeguata conservazione del campione sono elementi fondamentali. Per la maggior parte dei test è sufficiente un campione di sangue venoso che deve essere prelevato con delicatezza e rapidità, utilizzando una siringa o, preferibilmente, un sistema con provette sottovuoto pre-riempite con la corretta quantità di anticoagulante. Un prelievo lento, difficoltoso o troppo rapido può determinare l’attivazione piastrinica e di alcuni fattori della coagulazione, compromettendo l’esito dei test. Se il sangue è stato prelevato con una siringa, deve essere traferito rapidamente nella provetta e agitato con delicatezza.
Per la conta e stima piastrinica, è sufficiente un prelievo di sangue addizionato di K3-EDTA con uno striscio a fresco. Per gli studi di funzionalità piastrinica e per un’adeguata valutazione dell’emostasi secondaria, è necessario usare provette contenenti come anticoagulante il citrato di sodio (preferibilmente tamponato al 3,2%) in rapporto al sangue 1:9. Pertanto, è fondamentale riempire la provetta con il volume indicato. Se si esegue un prelievo per più esami (es. emocromocitometrico, profilo biochimico), è importante evitare contaminazione con altri anticoagulanti.
Una volta prelevato il sangue e trasferito nell’apposita provetta, è fondamentale un corretto stoccaggio del campione. Se l’esame richiesto è eseguito su plasma, sarà necessario centrifugare tempestivamente il campione a 2000 x g per 10 minuti. È consigliabile eseguire il test entro 4 ore, conservando il campione a temperatura ambiente. Qualora l’esame dovesse essere eseguito oltre le 48 ore, può essere indicato il congelamento del plasma fino all’esecuzione del test.
ESAMI DELL’EMOSTASI PRIMARIA
Conta e stima piastrinica
Per un corretto approccio alle alterazioni emostatiche primarie è fondamentale conoscere la conta (strumentale) e la stima (microscopica) delle piastrine. La valutazione al microscopio consente di verificare l’adeguatezza della conta strumentale e la morfologia piastrinica: ad esempio, la presenza di numerosi aggregati piastrinici può indurre un artificioso abbassamento della conta piastrinica, in quanto il singolo aggregato può essere erroneamente conteggiato come una singola piastrina; al contrario, la presenza di marcate lipemie può indurre un falso incremento della conta.
Variazioni della conta/stima piastrinica possono infatti indicare al clinico la presenza di una piastrinopenia o di una piastrinosi.
La piastrinopenia può dipendere da quattro diversi meccanismi:
- aumentato consumo (DIC)
- distruzione (tromobocitopenia immunomediata)
- mancata produzione (insufficienza midollare)
- sequestro (organomegalia, emorragia).
A fronte di una piastrinopenia i segni clinici (es. petecchie, Fig. 6) generalmente compaiono per conte/stime piastriniche inferiori a 30.000 cell/µL. I medesimi segni clinici possono comparire in corso di piastrinopatia, dove la conta piastrinica è verosimilmente normale, ma le piastrine non funzionano: un difetto del fattore di von Willebrand o uno stato di iperviscosità (ipergammaglobulinemia o eritrocitosi marcate) possono giustificare un difetto di adesione piastrinica. L’uso di farmaci antiaggreganti possono al contrario interferire nella fase di aggregazione piastrinica.
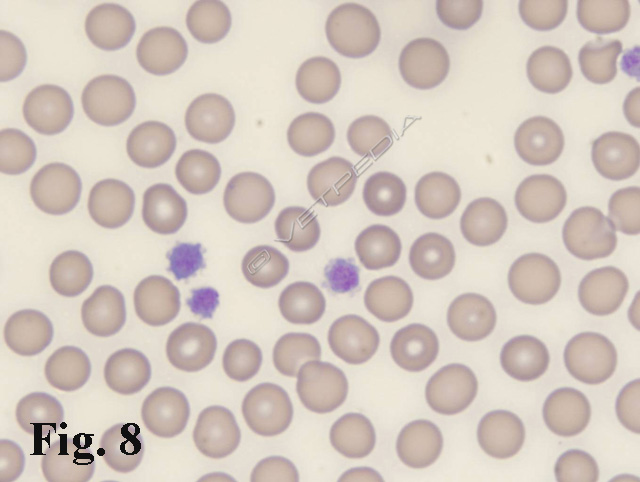
Degno di nota è il comune riscontro di piastrinopenia nel Cavalier King Charles Spaniel (Fig. 7), dove si registra frequentemente una macrotrombocitopenia asintomatica. Tale alterazione è determinata da una mutazione genetica ereditaria nella beta1-tubulina, che determina una formazione alterata delle pro-piastrine dai megacariociti. Ne deriva un numero inferiore di piastrine che appaiono più grandi (macropiastrine) (Fig. 8), pur mantenendo valori normali del piastrinocrito (PCT) che risultano normali. Questa presentazione è stata recentemente descritta negli Akita Inu.
La piastrinosi, invece, riconosce come cause:
- patologie infiammatorie croniche (piastrinosi reattiva);
- ipercorticosurrenalismo;
- perdite emorragiche croniche;
- splenectomia;
- disordini mieloproliferativi cronici primari a carico della sola filiera megacariocitaria (Trombocitemia Essenziale – TE) o associati a contestuale iperplasia mieloide ed eritroide (Policitemia Vera – PV);
- piastrinosi da rebound (a seguito di trattamento immunosoppressivo di una trombocitopenia immunomediata);
- farmaci (corticosteroidi, vincristina);
- neoplasie.
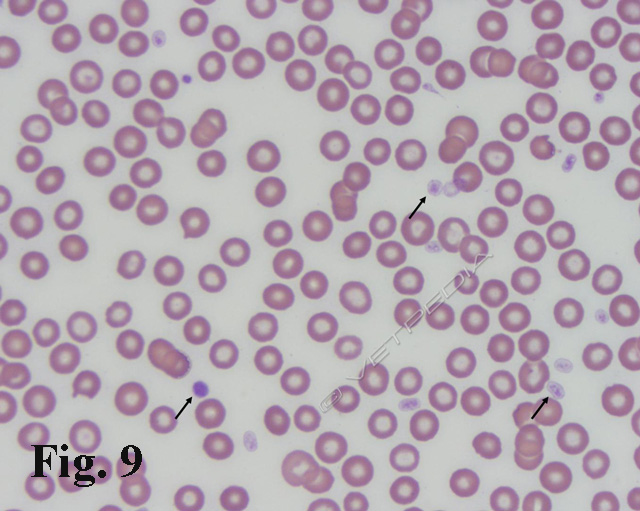
La stima piastrinica è una procedura che può essere eseguita anche in sede d’urgenza, in assenza di un analizzatore automatico, in quanto si stima che una piastrina in un campo ad immersione (100x) corrisponda approssimativamente a 15.000 cell/µL (Fig. 9).
TEST DI SANGUINAMENTO DELLA MUCOSA BUCCALE (BMBT)
Questo esame permette di escludere difetti dell’emostasi primaria in un soggetto che non presenta segni clinici evidenti di sanguinamento.
Nel paziente posizionato in decubito laterale, si rovescia il labbro, che viene tenuto sollevato con l’uso di una garza per impedire il ritorno venoso. Utilizzando un apposito dispositivo tagliente si praticano due incisioni sulla mucosa. Il sangue va tamponato con una carta assorbente non direttamente sull’incisione per non rimuovere l’eventuale coagulo. Il tempo di sanguinamento della mucosa buccale corrisponde al tempo trascorso dall’incisione fino al termine del sanguinamento. Un BMTM di circa 3 minuti è considerato normale, sopra i 5 minuti è prolungato. A causa della scarsa standardizzazione del test, i risultati vanno interpretati con cautela.
Aumento del BMBT:
- disfunzione endoteliale e microvascolare;
- trombocitopenia;
- trombocitopatia;
- farmaci (acido acetilsalicilico, clopidogrel);
- malattia di von Willebrand (vWd);
- sindrome uremica.
ESAME DEL MIDOLLO OSSEO
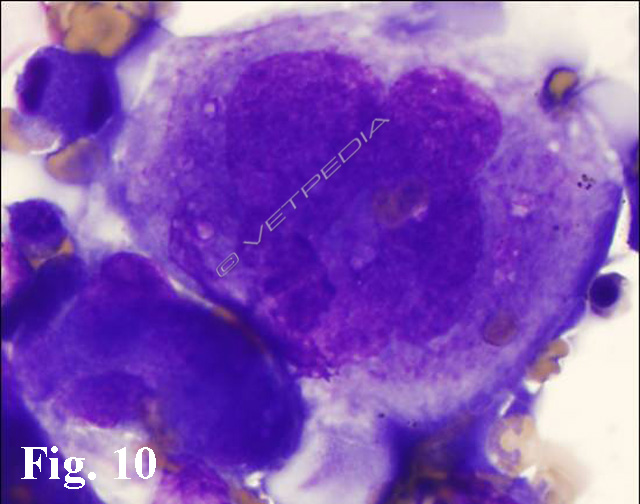
L’esame citologico del midollo osseo viene impiegato principalmente in corso di piastrinopenia per verificare l’adeguatezza numerica e la morfologia della filiera megacariocitaria (Fig. 10). In caso di piastrinopenia la presenza di una iperplasia megacariocitaria potrebbe suggerire una trombocitopenia immunomediata e/o una mielodisplasia. L’assenza o la scarsa rappresentazione potrebbe dipendere da un ipoplasia/aplasia midollare o da un disordine proliferativo neoplastico a sede midollare con conseguente effetto mieloftisico (compressione e sostituzione ad opera della popolazione neoplastica delle cellule residenti).
RICERCA DEGLI ANTICORPI ANTI PIASTRINE
L’impiego della citometria a flusso consente di rilevare l’eventuale presenza di anticorpi (IgG/IgM) sulla superficie delle piastrine in corso di trombocitopenie immunomediate. L’esame va eseguito su un campione di sangue intero in sodio citrato non refrigerato entro 24-36 ore dal prelievo.
PFA-100®
Il sistema PFA-100® consente in modo rapido di valutare difetti dell’emostasi primaria, con particolare rilevanza per i difetti di adesione piastrinica (es. deficienza del fattore di von Willebrand). L’esame va eseguito su un campione di sangue intero in sodio citrato entro poche ore (massimo 4 ore) dal prelievo.
FATTORE DI VON WILLEBRAND (vWF:Ag)
Per lo studio della carenza del vWF sono disponibili test antigenici e test genetici. Il dosaggio antigenico del vWF (vWF:Ag) si esegue mediante metodica ELISA su plasma ottenuto da sangue intero addizionato di sodio citrato centrifugato a 3000 giri per 10’ (o 4500 giri per 5’).
I test genetici consentono l’identificazione di mutazioni in omo ed eterozigosi per lo studio della deficienza del vWF in particolari razze predisposte.
- Malattia di Von Willebrand tipo I: si ricerca in Dobermann, Bernese, Coton de Tuler, Pinscher, Kerry Blue Terrier, Manchester Terrier, Pembroke Welsh Corgi, Barbone nano, Pastore scozzese. Questa forma è caratterizzata da una bassa concentrazione del fattore, ma tutte le forme di multimeri sono presenti, e solitamente si associa a sintomi lievi.
- Malattia di Von Willebrand tipo II: si ricerca in Deutsch Drahthaar, German Shorhaired Pointer, German Wirehaired Pointer. Questa forma è caratterizzata da una bassa concentrazione del fattore e da una perdita eccessiva del multimero ad alto peso molrcolare, con sintomi che variano da moderati a gravi.
- Malattia di Von Willebrand tipo III: si ricerca nello Scottish Terrier e nel Pastore delle Shetland (Shetland Sheepdog). In questa forma, è presente un'assoluta assenza del vWF, ed è associata a sintomi molto gravi.
Per l’esecuzione del test genetico, è richiesto sangue intero in K3-EDTA oppure 2 tamponi buccali che vanno sfregati vigorosamente sulla gengiva e il colletto.
ESAMI DELL’EMOSTASI SECONDARIA
Tempo di coagulazione attivato (ACT)
L’obiettivo del test è di valutare la cascata coagulativa intrinseca e comune in modo rapido e semplice (Fig. 11). Per tale scopo, viene utilizzata una diatomea (un tipo di alga) che attiva la via intrinseca, portando alla coagulazione del sangue. In una provetta, con pareti rivestita di diatomee si introducono 2 ml di sangue. La provetta va tenuta in termostato a 37°C e capovolta delicatamente e ripetutamente fino a quando si verifica la coagulazione. Si misura quindi il tempo che trascorre dal momento in cui il sangue viene aggiunto alla provetta fino a quando si forma il coagulo. Il valore normale dell’ACT in un cane è di 90-120 secondi, mentre nel gatto è < 75 secondi.
Un aumento dell’ACT può essere causato da:
- avvelenamento da rodenticidi (antagonisti della vitamina K);
- emofilia A e B;
- ipofibrinogenemia e difibrinogenemia;
- coagulazione intravasale disseminata (DIC);
- epatopatie
Tuttavia, data la scarsa sensibilità del test, il suo utilizzo è fortemente limitato. In caso di grave piastrinopatia/penia, il test potrebbe dare risultati alterati anche in assenza di alterazioni nell'emostasi secondaria.
Figura 12 Test di screening della coagulazione rapportati alla cascata coagulativa
Tempo di protrombina (PT)
L’obiettivo del test è di valutare la cascata coagulativa estrinseca nonché quella comune. Prima che il PT aumenti, le proteine coagulative devono ridursi in modo significativo, dato che le concentrazioni di alcuni fattori risultano particolarmente elevate nel cane (VII,V). Questo comporta che anche lievi spostamenti del PT siano determinati da gravi deficit coagulativi.
Alcune condizioni comuni che causano un allungamento de PT sono:
- DIC
- avvelenamenti da rodenticidi
- insufficienza epatica
- iperfibrinogenolisi primaria
- carenze congenite dei fattori della via estrinseca (es Beagle e deficienza del fVII)
- sindrome nefrosica
- paziente con ematocrito elevato (eccesso di anticoagulante rispetto al plasma)
- errato prelievo o errato rapporto tra sangue e anticoagulante.
Una riduzione del PT, anche se piuttosto infrequente, si può osservare negli stati di ipercoagulabilità.
Tempo di tromboplastina attivata (aPTT)
L’obiettivo del test è valutare la cascata coagulativa intrinseca nonché quella comune (Fig. 12). Tuttavia, rispetto al PT, sembra essere meno sensibile alle alterazioni della via comune. Anche questo test risulta alterato solo quando è presente una grave carenza dei fattori della coagulazione, pertanto è un test poco sensibile nei pazienti con deficit lievi o moderati. Alcune condizioni comuni che causano un allungamento de aPTT sono:
- Emofilia A (carenza del fVIII);
- Emofilia B (carenza del fIX);
- carenza congenita del fXII (gatto), del HMWK o della PK;
- terapia eparinica;
- insufficienza epatica;
- avvelenamenti da rodenticidi;
- ipofibrinogenemia e difibrinogenemia;
- iperfibrinogenolisi e iperfibrinolisi;
- DIC;
- coagulopatia post traumatica;
- sindrome nefrosica;
- paziente con ematocrito elevato (eccesso di anticoagulante rispetto al plasma);
- errato prelievo o errato rapporto tra sangue e anticoagulante.
Una riduzione dell’aPTT, anche se piuttosto infrequente, si può osservare negli stati di ipercoagulabilità. Questo test può essere utilizzato per il monitoraggio della terapia eparinica. Come nel caso dell'ACT, essendo un test che innesca la coagulazione a partire dall'attivazione del sistema a contatto, l'aPTT può risultare alterato in caso di carenza di questi fattori, anche se tale alterazione non è necessariamente associata a sintomi emorragici. Infatti, questi tre fattori non sembrano svolgere alcun ruolo nella coagulazione fisiologica in vivo.
Tempo di trombina (TT)
Il TT è un test che valuta le capacità funzionali del fibrinogeno, concentrandosi quindi solo sulla via comune della coagulazione (Fig. 12). Viene eseguito su plasma in sodio citrato e rappresenta il tempo necessario affinché si verifichi la formazione di un coagulo dopo l’aggiunta di alte concentrazioni di trombina. Cause che portano ad un aumento del TT:
- ipofibrinogenemia primaria e difibrinogenemia;
- insufficienza epatica;
- DIC;
- iperfibrinogenolisi e iperfibrinolisi;
- Accumulo di fattori di degradazione del fibrinogeno (FDP) e paraproteine (es. ipergammaglobulinemia neoplastica).
Fibrinogeno
Il fibrinogeno, essendo una proteina positiva moderata di fase acuta, in corso di processi flogistici può aumentare, mascherando possibili coagulopatie da consumo. Esistono diversi metodi per la misurazione del fibrinogeno, ma il più utilizzato in ambito veterinario è il metodo di Clauss. Si tratta di una metodica molto simile al TT, ma viene eseguita una conversione per quantificare la concentrazione del fibrinogeno a partire dal tempo.
Le cause che possono portare ad un aumento delle concentrazioni di fibrinogeno includono:
- infiammazione sistemica;
- neoplasie;
- gravidanze ed estrogeni;
- corticosteroidi
La riduzione del fibrinogeno può essere determinata da:
- perdite ematiche e consumo;
- DIC;
- insufficienza epatica;
- ipofibrinogenemia ereditaria (San Bernardo, Borzoi);
- iperfibrinogenolisi e iperfibrinolisi ;
- sepsi;
- emodiluizione secondaria a fluidoterapia;
- terapia trombolitica.
ESAMI DELL’EMOSTASI TERZIARIA
In ambito veterinario, purtroppo, non è possibile misurare la maggior parte delle molecole coinvolte nella fibrinolisi. Pertanto, questa fase viene valutata in base alla misurazione dei prodotti di degradazione generati durante l'emostasi terziaria.
Prodotti di degradazione della fibrina e del fibrinogeno (FDPs)
I prodotti di degradazione della fibrina e del fibrinogeno sono prodotti dall’azione proteolitica della plasmina sulla fibrina e in minor misura sul fibrinogeno.
Un incremento degli FDPs suggerisce:
- iperfibrinogenolisi primaria;
- DIC;
- emorragie interne e traumi;
- versamenti addominali e pleurici;
- insufficienza epatica (per mancata degradazione da parte delle cellule di Kupffer).
D-Dimeri
I dimeri D rappresentano i prodotti di degradazione della fibrina (creata per azione del fXIII) e non del fibrinogeno. L’evidenza di questa molecola indica la presenza di una coagulazione intravascolare. Pertanto, rispetto agli FDP, i D-Dimeri sono un marker migliore per la diagnosi di DIC e patologia tromboemboliche. Ne deriva che le cause che possono determinarne un incremento sono:
- DIC;
- trombosi;
- versamenti cavitari;
- insufficienza epatica (per mancata degradazione da parte delle cellule di Kupffer).
ESAMI CHE VALUTANO ANTICOAGULANTI ENDOGENI
Antitrombina (AT)
L'antitrombina è un anticoagulante circolante con azione inibente sulla trombina. Per la sua misurazione si utilizzano metodiche cromatografiche ed esprimono la concentrazione di AT in percentuale rispetto ad un valore standard, utilizzando un pool di animali sani. Un valore di AT inferiore al 50% è un fattore di rischio per lo sviluppo di trombosi. La riduzione dell'attività dell'AT può essere causata da un eccessivo consumo (come nel caso della coagulazione intravascolare disseminata - DIC), da una produzione insufficiente o ridotta (come nelle epatopatie), o da una perdita eccessiva in patologie proteino-dipendenti o perdite con essudati.
TROMBOELASTOGRAFIA
Di recente introduzione in campo veterinario tale test consente di valutare in tempo reale la fase di aggregazione piastrinica e i difetti emostatici secondari. Tra questi ultimi ricordiamo la DIC, l’ipercoagulabilità, l’iperfibrogenolisi e carenze congenite o acquisite di fattori della coagulazione. Limite di questo test è che va eseguito entro 30’ dal prelievo su sangue intero addizionato di sodio citrato.
Bibliografia
Davis B., Toivio-Kinnucan M., Schuller S. et al. – Mutation in b1-Tubulin Correlates with Macrothrombocytopenia in Cavalier King Charles Spaniels – J Vet Intern Med 2008;22:540–545
Feldman B.F., Zinkl J.G., Jain N.C. – Schalm’s Veterinary haematology, 5° edition, ed Lippincott Wlliams & Wilkins, 2000
Pedersen H.D., Haggstrom J., Olsen LH., et al. – Idiopathic asymptomatic thrombocytopenia in Cavalier King Charles Spaniels is an autosomal recessive trait – J Vet Intern Med 2002; 16:169-173
Stockham S.L., Scott M.A. – Fundamentals of Veterinary Clinical Pathology – 1° edition, Blackwell 2002
Willard M.D., Tveden H. – Small Animal Clinical Diagnosis by laboratory Methods – 4° edition, Saunders 2004
Brooks, M. B., Harr, K. E., Seelig, D. M., Wardrop, K. J., & Weiss, D. J. - Schalm's Veterinary Hematology, Wiley-Blackwell, 7° edition, 2022.
Davis, B., et al. "Mutation in β1‐tubulin correlates with macrothrombocytopenia in Cavalier King Charles spaniels." Journal of veterinary internal medicine 22.3 (2008): 540-545.
Hayakawa, Sayuri, et al. "A novel form of macrothrombocytopenia in Akita dogs." Veterinary Clinical Pathology 45.1 (2016): 103-105.
Kaae, Jennifer A., Mary Beth Callan, and Marjory B. Brooks. "Hereditary factor VII deficiency in the Alaskan Klee Kai dog." Journal of veterinary internal medicine 21.5 (2007): 976-981.
Maruyama, Haruhiko, et al. "Factor XII deficiency is common in domestic cats and associated with two high frequency F12 mutations." Gene 706 (2019): 6-12.
McMichael, Maureen. "New models of hemostasis." Topics in companion animal medicine 27.2 (2012): 40-45.
Pedersen, Henrik D., et al. "Idiopathic asymptomatic thrombocytopenia in Cavalier King Charles Spaniels is an autosomal recessive trait." Journal of veterinary internal medicine 16.2 (2002): 169-173.
Pesaresi M. - I disordini emostatici nel cane e nel gatto, manuale per la diagnosi e il trattamento. Ed. 1., Edra, 2020.
Stockham, Steven L., and Michael A. Scott. - Fundamentals of veterinary clinical pathology, John Wiley & Sons, Blackwell 2013.
Villiers, E., & Ristić, J. - BSAVA manual of canine and feline clinical pathology (No. Ed. 3). British Small Animal Veterinary Association, 2016.
Willard M.D., Tveden H. – Small Animal Clinical Diagnosis by laboratory Methods – 4° edition, Saunders 2004.