Morfina
- Disciplina: Anestesiologia
- Specie: Cane e Gatto
La morfina è stato il primo alcaloide dell’oppio ad essere isolato, nel 1806, ed è tuttora considerato il prototipo degli oppioidi (Fig. 1). La morfina esplica la sua attività agendo principalmente sui recettori µ. Le sue proprietà analgesiche sono correlate anche all’induzione di un marcato incremento nella produzione di serotonina. Gli effetti sul SNC della morfina comprendono analgesia, sonnolenza, cambiamenti dell’umore come euforia, sedazione, letargia e apatia. L’analgesia indotta dalla somministrazione di morfina è provocata dall’inibizione selettiva di vari riflessi nocicettivi; il farmaco agisce sui recettori µ posti a livello centrale determinando un’alterazione sia della percezione del dolore che della reattività allo stesso. L’effetto analgesico indotto dalla morfina è completamente antagonizzato dalla somministrazione di nalossone (Miller, 2006). Il meccanismo d’azione è quello degli altri oppiacei.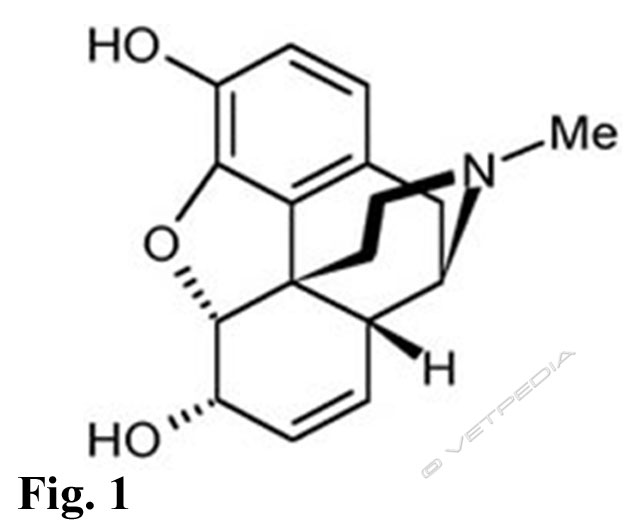
La farmacocinetica della morfina è notevolmente influenzata dalla sua elevata idrofilicità. In effetti la penetrazione di questo alcaloide verso il cervello e fuori da esso, è molto più lenta rispetto a quella di altri oppioidi, per un lento passaggio attraverso la barriera emato-encefalica. Il “first-pass” polmonare, che ne causa il sequestro temporaneo è trascurabile (Boer 1992). Possiede inoltre una costante di dissociazione (pKa 8,0) maggiore del pH fisiologico che causa un basso grado di ionizzazione a seguito d'iniezione endovenosa (10% - 20%). Il legame con le proteine plasmatiche, e particolarmente all’albumina, è molto basso (circa il 20 – 40%). L’emivita nel cane è di circa 60 minuti (Waterman-Pearson 2003).
La morfina è metabolizzata principalmente nel fegato a seguito di un processo di glucuronazione, ma anche il rene possiede un ruolo chiave nel metabolismo extraepatico (Merrell 1990). La morfina-3-glucuronide (M3G) è il metabolita principale, ma questo non è in grado di legarsi ai recettori degli oppioidi, mostrando quindi un’attività analgesica scarsa o nulla. Al contrario sembra in grado di contrapporsi alla morfina e questo effetto può contribuire sia alla variabilità nella risposta che alla resistenza alla terapia analgesica a base di morfina.
La morfina-6-glucuronide (M6G) rappresenta quasi il 10% dei metaboliti della morfina ed è un agonista del recettore µ più potente della stessa morfina e simile durata d’azione. È stato riportato che l’M6G contribuisce sostanzialmente agli effetti analgesici della morfina anche in pazienti con funzione renale normale (Portenoy 1992). In pazienti con disfunzione renale, invece, l'accumulo di M6G può determinare aumento degli effetti indesiderati, compresa la depressione respiratoria. Uno studio recente ha suggerito che il singolo polimorfismo del nucleotide sul recettore µ, sia correlabile alla predisposizione alla tossicità del M6G (Lotsch 2002). Poiché il metabolismo epatico di primo passaggio è alto, la biodisponibilità di morfina somministrata per via orale è significativamente minore (20% - 30%) rispetto a quando viene somministrata per via parenterale. L’M6G è il metabolita attivo primario quando la morfina viene somministrata oralmente (Osborne 1990). Tuttavia, mentre alcuni studi suggeriscono l'elevata potenza dell’M6G, altri evidenziano che l’infusione endovenosa dell’M6G non fornisce analgesia efficace (Motamed 2000).
L’azione della morfina sui recettori situati a livello della corteccia cerebrale determina analgesia, sedazione (Figg. 2 e 3) fino all’ipnosi a dosaggi elevati; l’effetto analgesico è comunque dovuto anche all’interazione con i recettori specifici situati nel midollo spinale.

Come alcuni altri oppioidi (morfino-simili) ad azione agonista, la morfina causa modica ipotensione e vasodilatazione per l’azione esercitata sul centro vasomotore; la liberazione di istamina a causa della stimolazione dei mastociti, può incrementare lo stato ipotensivo. È inoltre frequente l’insorgenza di bradicardia, che sarà di grado marcato soprattutto quando la somministrazione di morfina è effettuata sull’animale che non subisce stimoli algici (fase della premedicazione) (Video 1); la bradicardia sarà meno evidente se l’animale prova dolore (es. periodo postoperatorio) (Pascoe 2000). Sono riportati anche casi in cui può verificarsi tachicardia e vasocostrizione coronarica con aumento della resistenza vascolare coronarica (Lukasik 2003).
La morfina deprime sempre la respirazione in modo dose-dipendente. A bassi dosaggi gli effetti potrebbero essere clinicamente irrilevanti, ma a dosaggi più elevati si verifica diminuzione del volume minuto per riduzione della frequenza respiratoria e/o del volume tidalico. In soggetti non ancora sottoposti ad anestesia e che non ricevono alcuno stimolo dolorifico (es. fase della premedicazione) possono manifestare un tipo di respiro superficiale e affannoso, che non contribuisce a diminuire l’anidride carbonica arteriosa (PaCO2). Questa sintomatologia di respirazione affannosa denominata anche “panting” è legata principalmente agli effetti diretti sul centro termoregolatore ipotalamico (Video 2). La morfina somministrata a dosi da moderate ad alte, può causare broncocostrizione (Lukasik 2003).
La morfina possiede anche effetto antitussigeno centrale, induce miosi (ad eccezione del gatto dove si verifica midriasi) e stimola sia il centro del vomito (CTZ) causando emesi (Fig. 3, vedi Video 3), sia lo sfintere di Oddi con aumento del tono basale. A livello intestinale agisce invece in due modi diversi: attraverso stimolazione vagale causa aumento della peristalsi, mentre agendo direttamente sulla sua muscolatura, ne provoca contrazione spasmodica e prolungata che va ad inibire i movimenti peristaltici. Se la somministrazione di morfina è unica e non ripetuta, questi effetti intestinali non saranno evidenti, mentre se la sua somministrazione è continua si potrebbero riscontrare situazioni di costipazione.
La stimolazione del nucleo sopraottico ipotalamico da parte della morfina induce aumento della secrezione di ADH da parte dell’ipofisi posteriore e, quindi, a maggiore ritenzione idrica da parte del rene; mentre la depressione dell’ipofisi anteriore causa riduzione della secrezione di ACTH e di gonadotropine. La morfina soprattutto se somministrata per via epidurale può determinare disfunzione del detrusore vescicale e mancata urinazione. Si consiglia pertanto di cateterizzare l’uretra di tutti i pazienti sottoposti ad epidurale con morfina per prevenire gravi dilatazioni vescicali.
UTILIZZO CLINICO
La morfina è indicata nel trattamento del dolore moderato ed intenso e può essere somministrata per via intravenosa, intramuscolare, sottocutanea, intra-articolare ed epidurale. Grazie all’azione depressante centrale, consente di ridurre della metà fino anche ad un terzo, la dose di anestetico necessaria a produrre l’anestesia chirurgica (Boothe 1999). Le dosi raccomandate per il cane variano da 0,2 a 1 mg/kg per via sottocutanea o intramuscolare ed ha una durata d’azione di 2 - 4 ore a seconda del dosaggio impiegato (Pascoe 2000) (Video 3).
Nel gatto, più sensibile ai fenomeni eccitativi indotti dagli oppioidi, si scende a 0,2-0,5 mg/kg, con una durata maggiore fino a 6 ore, forse per gli effetti del metabolita M6G che nel gatto potrebbe svolgere un ruolo primario nella durata degli effetti clinici. In uno studio clinico, la morfina alla dose di 0,3 – 0,8 mg/kg, è stata capace di assicurare una buona analgesia, per almeno 4 ore, nel 70% circa dei cani esaminati che erano stati sottoposti a varie procedure ortopediche (Taylor,1984). Brodbelt (1997), ha invece notato analgesia adeguata nelle 7 ore successive all’esecuzione di artrotomia in cani che avevano ricevuto 0,3 mg/kg di morfina intramuscolare.
Come già accennato, quest’oppioide si può somministrare anche per via endovenosa ma, in questo caso, l’infusione deve avvenire molto lentamente per evitare liberazione d’istamina da parte dei mastociti (Kukanich, 2005; Guedes, 2006); questa secondo Pascoe (2000) è correlata alla velocità d’infusione ed al dosaggio utilizzato.
È stata utilizzata, con successo, anche l’infusione endovenosa continua, con dosaggi che variano da 0,1 ad 1 mg/kg/ora, a seguito di un bolo iniziale di 0,3 – 0,5 mg/kg intramuscolare o endovenoso (Pascoe, 2000) (Video 4).
Secondo Kukanich (2005), sono invece sufficienti 0,15 mg/kg/ora in infusione endovenosa continua oppure boli di 0,5 mg/kg, ripetuti ogni 2 ore, per mantenere un livello analgesico adeguato.
Per prevenire la scialorrea e le ipersecrezioni bronchiali si può somministrare la morfina insieme ad atropina (0,02-0,04 mg/kg). Il cane sedato con morfina deve comunque essere manipolato con delicatezza in quanto procedure o rumori bruschi possono svegliarlo e provocare delirio o disforia (Bhoot 1999).
Come già detto precedentemente, la morfina si è dimostrata molto efficace nella somministrazione epidurale (Fig. 4) in quanto risulta in grado di fornire analgesia per 16-24 ore con dosaggi da 0,1 a 0,2 mg/kg, anche se il farmaco inizia a dimostrare i propri effetti analgesici solo dopo 20-60 minuti (Smith 2001; Bufalari, 2008). Gli effetti collaterali, ed in particolare quelli a carico dell’apparato cardiovascolare, vengono ad essere notevolmente limitati; tuttavia si possono verificare depressione respiratoria tardiva e ritenzione urinaria (Waterman-Pearson, 2003).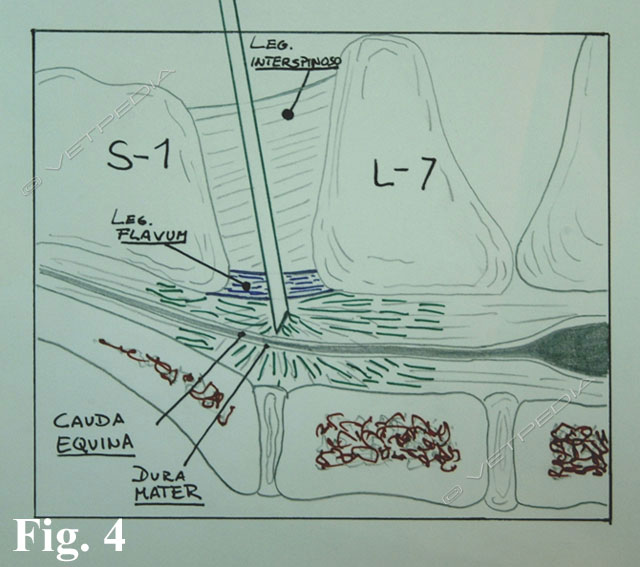
Bibliografia
- Miller’s Anaesthesia. Miller R. D. 6° ed., 2005
- Boer F., Bovill J.G., Burm A.G., Mooren R.A., “Uptake of sufentanil, alfentanil and morphine in the lungs of patients about to undergo coronary artery surgery.” Br J Anaesth, 1992, 68:370–375.
- Waterman-Pearson A.E., “Analgesia”. In: Anestesia e Analgesia, Seymour C., Gleed R., 2003. UTET. p. 66-78.
- Merrell WJ, Gordon L, Wood AJ, et al, “The effect of halothane on morphine disposition: relative contributions of the liver and kidney to morphine glucuronidation in the dog.” Anesthesiology, 1990, 72:308–314.
- Portenoy RK, Thaler HT, Inturrisi CE, et al., “The metabolite morphine-6-glucuronide contributes to the analgesia produced by morphine infusion in patients with pain and normal renal function”. Clin Pharmacol Ther, 1992, 51:422–431.
- Lotsch J, Zimmermann M, Darimont J, et al, “Does the A118G polymorphism at the mu-opioid receptor gene protect against morphine-6-glucuronide toxicity?”. Anesthesiology, 2002, 97:814–819.
- Osborne R., Joel S., Trew D., Slevin M. “Morphine and metabolite behavior after different routes of morphine administration: demonstration of the importance of the active metabolite morphine-6-glucuronide”. Clin Pharmacol Ther, 1990, 47:12–19.
- Motamed C., Mazoit X., Ghanouchi K., et al, “Preemptive intravenous morphine-6-glucuronide is ineffective for postoperative pain relief”. Anesthesiology, 2000, 92:55–360.
- Lukasik V.M., “Premedicazione e sedazione”. In: Anestesia e Analgesia, Seymour C., Gleed R., 2003. UTET, 79-94.
- Pascoe P.J., “Opioid Analgesics”. In: Veterinary Clinics of North America: Small Animal Practice, 2000; 30: 757-772.
- Boothe D.M., “Control of pain in small animals: opioid agonists and antagonist and other locally and centrally acting analgesics”. In: Small animal clinical pharmacology and therapeutics, Ed. W.B. Saunders Company, 2001, 405-424.
- Taylor P.M., Houlton J.E.F., “Post-operative analgesia in the dog: A comparison of morphine, buprenorphine and pentazocine”. J Small Anim Pract,1984, 25: 437.
- BrodbeltD.C., Taylor P.M., Stanway G.W., “A comparison of pre-operative morphine and buprenorphine for post-operative analgesia for artrotomy in the dog”, J Vet Anaesth, 1997, 20(4): 284-289.
- Guedes A.G.P., Elaine P.R., Rider M.A., “Evaluation of histamine release during constant rate infusion of morphine in dogs”. Vet anaest analg, 2006, 33: 28-35.
- Smith L.J., Kwan-An Yu J., “A comparison of epidural buprenorphine with epidural morphine for postoperative analgesia following stifle surgery in dogs”. Veterinary anaesthesia and analgesia, 2001, 28: 87-96.
- Bufalari A, Nannarone S, Maggio C, Bordoni T, Arcelli R, Di Meo A (2008). Sufentanil vs Morfine for epidural analgesia in the dog. In: Proceedings AVA Autumn Meeting. Barcellona, 2008.



