Sistemi e circuiti respiratori
- Disciplina: Anestesiologia
- Specie: Cane e Gatto
La definizione e la classificazione dei metodi con cui sono somministrati gli anestetici inalatori sono state sottoposte a continue modifiche a partire dalle origini dell’anestesia. La maggior parte della letteratura anestesiologica corrente utilizza le definizioni e classificazioni qui descritte.
DEFINIZIONI
- Sistemi di respirazione. Un sistema di respirazione (non è un circuito), descrive il modo di funzionamento dell’apparecchiatura con cui vengono somministrati gli agenti inalatori al paziente. Per esempio, un sistema di respirazione di tipo Mapleson E (modalità di funzionamento) descrive come funziona un sistema respiratorio pezzo a T di Ayres (apparecchiatura);
- Rirespirazione. La rirespirazione, in sistemi d’anestesia, si riferisce convenzionalmente all’atto di inspirare alcuni o di tutti i gas espirati in precedenza, tra cui l'anidride carbonica e il vapore acqueo;
- Spazio morto dell’apparecchiatura. Questo si riferisce al volume che è all'interno dell'apparato e che contiene gas esalato dal paziente, che sarà re-inalato a partire dall’inizio della successiva fase inspiratoria.
CLASSIFICAZIONE DEI SISTEMI DI RESPIRAZIONE
Possono essere classificati in base alla funzione:
- Sistemi senza rirespirazione che utilizzano valvole di non-rirespirazione;
- Sistemi in cui la rirespirazione è possibile ma è normalmente evitata dal flusso dei gas freschi attraverso il sistema;
- Sistemi senza rirespirazione che usano assorbitori dell'anidride carbonica:
- sistemi unidirezionali (rotatori);
- sistemi bi-direzionali (va e vieni);
Sistemi senza rirespirazione
Il modo più semplice di fornire un costante approvvigionamento di gas freschi a un paziente è tramite l’uso di sistemi che comprendano una o più valvole di non-rirespirazione. I gas freschi entrano nel sistema attraverso il ramo inspiratorio. I tubi che portano il gas al paziente devono essere tali da ridurre al minimo le resistenze all’inspirazione e, allo stesso tempo, devono essere realizzati in modo che non collassino a seguito della depressione inspiratoria, permettano di essere piegati senza inginocchiarsi e non abbiano rugosità sulla loro faccia interna. Tutte queste caratteristiche vengono spesso realizzate con l’uso di un tubo in materiale plastico sottile a cui viene fissata una spirale sulla faccia esterna. I gas freschi che entrano sono risucchiati dalla sforzo inspiratorio del paziente o insufflati in ventilazione controllata. L’entrata dei gas è consentita da una valvola inspiratoria che impedisce, al successivo atto espiratorio, che il gas ricco di CO2 si mescoli con il gas fresco. La stessa valvola o una diversa impedisce che il gas inspirato provenga dal ramo espiratorio durante l’inspirazione.
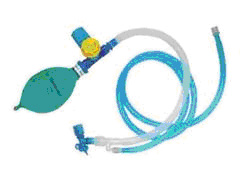
L’utilizzo di dispositivi come quelli mostrati in Figura 1, prevede la presenza di una borsa respiratoria connessa al ramo inspiratorio che raccolga anche il flusso fresco. Può anche essere compressa manualmente per fornire respirazione assistita o controllata, dal momento che la valvola di non rirespirazione è altrettanto efficace in questa modalità che in respirazione spontanea. Ovviamente, affinché la borsa respiratoria non collassi, il flusso dei gas freschi (FGF) non deve essere inferiore al volume minuto richiesto dal paziente.
Sistemi in cui è possibile la rirespirazione
Una miscellanea di sistemi respiratori è stata sviluppata dai pionieri dell’anestesia (in gran parte su base intuitiva); tali circuiti permettono l’assunzione dei gas da parte dei pazienti e la loro eliminazione dal circuito. L’eliminazione di biossido di carbonio è stata realizzata mediante l'azione di lavaggio di gas freschi introdotti in questi sistemi di respirazione, piuttosto che per la separazione delle miscele di gas inspirato ed espirato da una valvola come descritto sopra. Qualora il flusso fresco diminuisca il circuito consente la rirespirazione.
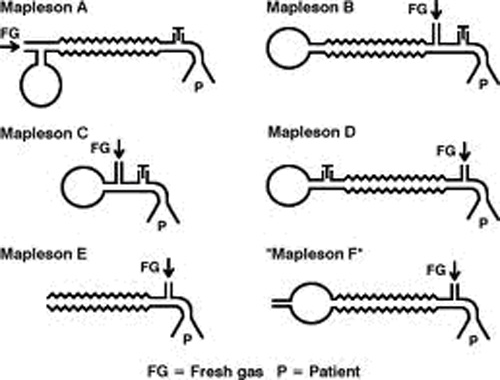
Nel 1954 Mapleson classificò questi sistemi con lettere che vanno dalla A alla E, in base alla loro capacità di eliminare l'anidride carbonica (efficienza) durante la respirazione spontanea. Un sistema F (circuito di Jackson Rees), che modifica il sistema E (pezzo a T di Ayre’s), è stato successivamente aggiunto alla classificazione da Willis nel 1975 (vedi sotto).
Classificazione di Mapleson dei sistemi respiratori
Questi circuiti contengono invariabilmente le medesime componenti variamente posizionate: arrivo dei gas freschi, connessione con il paziente, valvola di scarico (APL) e borsa respiratoria. In base a come queste parti sono combinate fra loro nel circuito, lo stesso avrà caratteristiche diverse (Fig. 2).
Tuttavia, l'efficienza di ogni sistema è diversa. Essi sono catalogati (A, B, C, D, E, F) in ordine del fabbisogno di FGF, dal più basso al maggiore, per evitare la rirespirazione durante la respirazione spontanea. Un sistema A richiede 0,8-1 volte la ventilazione minuto del paziente, B e C richiedono 1,5-2 volte la ventilazione minuto del paziente e i sistemi D, E e F (con funzionalità simili) richiedono 2-4 volte la ventilazione minuto del paziente per prevenire la rirespirazione durante la respirazione spontanea.
PRINCIPI DI FUNZIONAMENTO DEI SISTEMI RESPIRATORI
Mapleson A
Il Mapleson A è un sistema di respirazione che spiega il funzionamento del circuito di Magill, il cui nome deriva da Sir Ivan Magill che lo inventò nel 1920. E’ possibile trovarlo comunemente in configurazione da paziente umano adulto, ma esiste anche per paziente pediatrico.
Il sistema di Magill si compone dei seguenti elementi:
- L’ingresso dei gas freschi collegato a una borsa respiratoria da 2 litri. (Il gas espirato non dovrebbe mai raggiungere la borsa respiratoria, se la rirespirazione vuole essere evitata!). Questo è collegato a:
- Un tubo corrugato di respirazione (lunghezza minima per un circuito per paziente umano adulto di 110 centimetri e volume interno di 550 ml). Questo rappresenta poco più del volume tidalico medio di un adulto anestetizzato che respira spontaneamente. Questo volume è critico per evitare che gas alveolare raggiunga il pallone respiratorio, provocando rirespirazione. Questo è a sua volta collegato a:
- Valvola APL per l’eliminazione dei gas esalati. Questa valvola è presente in prossimità della connessione al tracheotubo del paziente.
Il sistema fa uso efficiente del gas fresco durante la respirazione spontanea. Ciò può essere spiegato esaminando la sua funzione nel corso di un ciclo respiratorio costituito da tre fasi: l'inspirazione, l’espirazione e una pausa di fine espirazione.
- Prima inspirazione. La borsa respiratoria e il tubo di respirazione sono stati riempiti da gas freschi e il paziente è in procinto di procedere alla prima inspirazione. L'intero sistema è quindi pieno di gas freschi. Come il paziente inspira, i gas sono aspirati nei polmoni con un flusso maggiore di FGF e così la borsa respiratoria si svuota in parte.
- Espirazione. Il paziente ha cominciato a espirare, e poiché la borsa respiratoria non è piena, i gas esalati risalgono lungo il tubo corrugato, spingendo i gas freschi dal tubo verso la borsa respiratoria. Tuttavia, prima che i gas esalati possano passare nella borsa respiratoria (da qui l'importanza della lunghezza del tubo inspiratorio), la valvola APL si deve aprire scaricando la gran parte dell’espirato. Affinché questo accada la borsa respiratoria deve essere stata almeno parzialmente riempita dal FGF, cosi che, quando la borsa fosse piena, la valvola APL si aprirebbe facendo fuoriuscire l’espirato.
La prima parte del gas esalato che riempie il tubo corrugato proviene dallo spazio morto anatomico che, quindi, non contiene anidride carbonica. Tale gas è scaldato e leggermente umidificato, il che costituisce una situazione ideale, perche poi sia nuovamente inalato. La seconda parte del gas espirato è invece carica di anidride carbonica e potrebbe causare rirespirazione. Parte di questo gas procede nel tubo corrugato, un altro viene eliminata direttamente dalla APL, tuttavia, durante la pausa espiratoria, il flusso fresco sospinge i gas espirati dal tubo corrugato verso la fuoriuscita tramite la valvola APL. Ne consegue che la pausa espiratoria risulta essere importante, affinché il paziente non abbia rirespirazione. Quando il paziente inspira nuovamente, i gas provenienti dallo spazio morto anatomico potranno essere re-inalati senza causare rirespirazione. Questo fa si che i FGF possano essere addirittura minori del volume minuto del paziente.
In teoria, se non ci fosse miscelazione dei gas freschi con quelli espirati e se la pausa espiratoria fosse abbastanza lunga, i flussi freschi potrebbero semplicemente essere pari alla ventilazione alveolare (circa il 66% del volume minuto), in questa situazione solo il gas alveolare sarebbe eliminato attraverso la valvola APL. In pratica, però, una serie di fattori determinano la necessità di utilizzate flussi maggiori (70-90% del volume minuto), per esempio:
- realmente vi è miscelazione delle diverse interfacce dei gas, che riduce l'efficienza teorica del sistema;
- occasionalmente, specie in cani di grossa taglia, il volume tidalico può essere maggiore del volume del tubo corrugato ed è possibile che il gas espiratorio raggiunga la borsa respiratoria, nel qual caso l’anidride carbonica contaminerà la borsa serbatoio e quindi il gas inspiratorio successivo;
- la frequenza respiratoria molto alta ridurrà o eliminerà la pausa espiratoria, riducendo il potenziale di eliminazione di anidride carbonica che questa pausa permette.
Come funziona?
Magill (Mapleson A) con ventilazione controllata
La dinamica dei gas sopradescritti riguarda l’uso del Mapleson A usato in respirazione spontanea. Tuttavia, se è utilizzata la ventilazione controllata, la dinamica di funzionamento del circuito subisce alcune alterazioni:
- Fase inspiratoria. La valvola APL deve essere tenuta chiusa in modo che sia possibile sviluppare una pressione sufficiente nel sistema polmonare. Durante la prima fase inspiratoria l'anestesista spreme la borsa respiratoria e parte dei gas freschi fuoriescono dalla valvola APL semichiusa.
- Fase espiratoria. Alla fine dell’ispirazione, la borsa respiratoria può essere quasi vuota e non appena l'anestesista la rilascia, il paziente esala nel tubo corrugato. L’esalato proveniente sia dallo spazio morto anatomico sia dagli alveoli risale il tubo corrugato molto di più, rispetto a ciò che succederebbe nella respirazione spontanea. Parte di questo gas ricco di anidride carbonica può arrivare anche alla borsa respiratoria. In questa situazione la valvola APL o non si apre o la sua apertura è ritardata. Quando l'anestesista spreme la borsa di nuovo, la rirespirazione sarà molto probabile. Per evitare ciò, i gas freschi devono essere aumentati in maniera tale da eliminare il gas espiratorio, prima della susseguente inspirazione e soprattutto per impedire che tale gas arrivi alla borsa respiratoria. Questo aumento, di solito, porta i gas freschi ad un flusso pari a due volte il volume minuto del paziente. Tale situazione è aumenta lo spreco di gas freschi e il rischio di inquinamento delle sale operatorie.
Altri circuiti che funzionano come Mapleson A
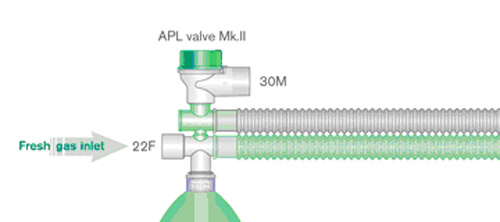
Circuito di Lack parallelo coassiale (Fig. 3)
Non è altro che un sistema di Magill dove la valvola APL sia stata portata vicino alla borsa respiratoria, tramite l’utilizzo di un tubo corrugato simile a quello che collega la borsa respiratoria stessa alla bocca del paziente. Questo accorgimento rappresenta un’evoluzione del Magill ed è teso a superarne i seguenti difetti:
- ridotto accesso alla valvola APL da parte dell’anestesista che deve infilarsi sotto i drappeggi qualora il paziente sia sottoposto ad interventi della testa e del collo;
- notevole trazione del circuito sul tracheotubo, a causa del peso della valvola e della rigidità alla torsione che può acquisire il sistema, quando la valvola è collegata al tubo di scarico
Il sistema di Lack supera questi due problemi. La versione originale è stata costruita con un circuito co-assiale, il gas inspirato passa attraverso il tubo esterno mentre il gas espirato dentro l’interno. Il tutto risulta meno ingombrante da usare e il tracheotubo (se i tubi non sono troppo rigidi) è sottoposto a minor stress. La valvola è posta vicino all’anestesista quindi è facilmente accessibile in qualsiasi circostanza e non grava sul tracheotubo. Grazie alla separazione (parziale) dei flussi inspiratorio e espiratorio il sistema di Lack è ritenuto marginalmente più efficiente del Magill.
Come funziona?
Sistema di Lack parallelo (Parallel Lack)
I sistemi di respirazione coassiali hanno il rischio che il tubo interno si disinserisca o si rompa, senza che questo sia notato dall’anestesista. Tale evento porterebbe ad una grave alterazione del funzionamento del sistema aumentando anche drasticamente lo spazio morto. Per ovviare a questo rischio è disponibile il parallel Lack che prevede la presenza di due tubi distinti, uno inspiratorio e l’altro espiratorio.
Sistemi Mapleson B e C
Questi sistemi hanno l’arrivo dei gas freschi, la borsa respiratoria e la valvola APL più vicine al paziente. Uno dei circuiti che segue lo schema del Mapleson C, è il va e vieni. Circuito molto diffuso in Italia, che essendo d’ingombro minimo, può essere spostato a piacimento rispetto al carrello d’anestesia, prolungando semplicemente il tubo dei gas freschi e quello di scarico. Tuttavia, come già detto, non sono efficienti come il Mapleson A. Le ragioni sono illustrate qui sotto per il va e vieni:
- La prima ispirazione. Il sistema è inizialmente pieno di gas freschi in modo che durante la prima ispirazione il paziente respiri solo gas freschi.
- Espirazione. Durante l'espirazione, il gas esalato (gas dello spazio morto inizialmente e poi la prima parte del gas alveolare), miscelato con i gas freschi, va nella borsa respiratoria. Quando quest'ultimo è stato riempito, il resto dell’esalato (il resto del gas alveolare) e l'FGF vengono eliminati tramite la valvola APL.
- Pausa di fine espirazione. Durante questa fase, il gas fresco fuoriesce dalla valvola APL perché questo è più vicino della borsa respiratoria.
- L'ispirazione successiva. Il gas inalatoproverrà dalla borsa respiratoria ed è una miscela di gas fresco, gas proveniente dallo spazio morto anatomico e gas alveolare, la cui proporzione sarà determinata dal livello di FGF e la pausa espiratoria. Se l'FGF è elevato e il tasso di esalazione è lento, ci sarà una maggiore quantità di gas freschi nell’inspirato.
Il “va e vieni” è uno dei circuiti più diffusi in anestesia veterinaria in Italia. Il suo maggiore vantaggio è la compattezza e quindi il suo scarso ingombro. A fronte di questo vantaggio, che si riflette anche in un costo contenuto, questo circuito presenta una serie di svantaggi da tenere ben presenti. La borsa respiratoria fornisce i gas per l’inspirazione e raccoglie anche il gas alveolare espiratorio. Questo fa si che la rirespirazione sia difficilmente eliminabile anche usando alti flussi, di conseguenza, il sistema è poco efficiente (utilizzo con vFGF pari a 2-3 volte il volume minuto del paziente). Il suo scarso ingombro fa si che il circuito rimanga spesso coperto dal drappeggio e risultando poco accessibile all’anestesista. Non è adatto ai pazienti più piccoli per le sollecitazioni a cui sottopone il tracheotubo. Questo non dipende per lo più dal peso del circuito, che è minimo, ma dal fatto che il tubo dei gas di scarico e quello dei gas freschi sono spesso rigidi o pesanti, aumentando la rigidità del sistema. In definitiva l’autore sconsiglia l’utilizzo di questo circuito, ritenendo che la sua diffusione sia da riferirsi più ad una scarsa conoscenza dei circuiti a disposizione piuttosto che ai reali vantaggi che il circuito possa offrire.
Sistema Mapleson D
Sistema Mapleson D con respirazione spontanea
Il sistema è spiegato meglio se, ancora una volta, le tre fasi del ciclo respiratorio sono considerate separatamente: inspirazione, espirazione e la pausa di fine espirazione:
- Prima inspirazione. L'FGF entra il più vicino possibile al tracheotubo del paziente (in modo da ridurre lo spazio morto) e il sistema viene riempito in modo che durante la prima inspirazione il paziente respiri solo gas freschi. Saranno inalati i gas presenti nel tubo connesso alla borsa respiratoria.
- Espirazione. Durante l'espirazione, il gas esalato, miscelato con l'FGF passa nel tubo connesso alla borsa respiratoria e quando questa è stata riempita il resto dell’esalato e dei FGF se ne và attraverso l’APL.
- Pausa di fine espirazione. In questa fase il FGF spingerà i gas espirati verso la borsa respiratoria e attraverso l’APL. Maggiore sarà la pausa tra le prime due fasi descritte minore sarà la probabilità di rirespirazione a parità di FGF. Altro aspetto importante è che il volume del tubo connesso alla borsa respiratoria deve esse di volume superiore al tidalico del paziente . Se il gas inspirato proviene dalla borsa la rirespirazione sarà inevitabile. I FGF adottati in questa modalità sono circa 3 volte il volume minuto del paziente.
Sistema Mapleson D con ventilazione controllata
La ventilazione controllata rende più efficiente questo sistema. Il motivo risiede nel fatto che la frequenza respiratoria e la pausa espiratoria possono essere imposti e ottimizzati. Frequenza respiratoria bassa, volume tidalico aumentato e pausa espiratoria protratta aumentano l’efficienza del sistema che si palesa con l’abbassamento del FGF che eviti la rirespirazione a 2 volte il volume minuto (alcuni testi segnalano anche l’utilizzo di FGF pari a 0,7 volte il volume minuto). Il sistema può essere ottimizzato in maniera tale da far occupare lo spazio morto anatomico da gas espirati. Ovviamente questo non causerebbe rirespirazione, tuttavia il confine tra gas fresco ed espirato non è netto e una certa quota di miscelazione dovuta anche alla turbolenza del flusso.
l Mapleson D è quindi impiegabile vantaggiosamente in ventilazione controllata sia per la maggiore efficienza, sia perché la connessione al ventilatore risulta molto semplice. La borsa respiratoria può essere rimossa e sostituita con un tubo corrugato di capacità sufficienti per accogliere l'aria o ossigeno che viene erogata dal ventilatore, impedendo che tale gas raggiunga il paziente diluendo i gas anestetici.
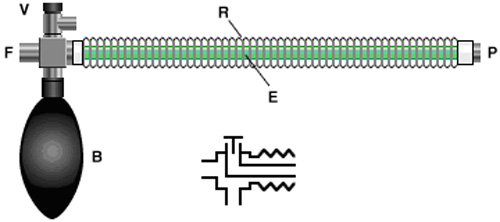
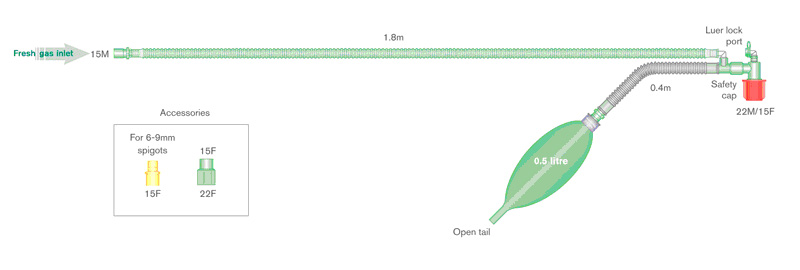
Sistema di Bain
Il sistema di respirazione Bain (Fig. 6) è simile in funzione al sistema Mapleson D. L'unica differenza è che il FGF è portato da un tubo all'interno del corrugato flessibile (circuito coassiale). Questo tipo di Mapleson D ha il vantaggio di essere poco ingombrante, ma se il tubo interno si lacera o si disconnette a livello della connessione distale può causare dei grossi problemi. In tal caso tutto il volume del circuito tra la disconnessione e il tracheotubo diventerebbe spazio morto. In teoria il tubo interno essendo sottile si potrebbe inginocchiare, arrestando il FGF al paziente.
Un certo numero di sistemi di respirazione sono stati descritti che, per mezzo di un interruttore a levetta, in grado di convertire il sistema da un Mapleson A a un Mapleson D o E, consentono di scegliere il sistema che si adatti maggiormente al tipo di procedura o di paziente. Il sistema di Humphrey ADE (Anaequip UK) sembra essere una versione tra le più popolari nel mondo anglosassone.
Sistema di Humphrey
Consiste in un blocco metallico composto da una valvola APL, due attacchi, uno per il ramo inspiratorio uno per il ramo espiratorio e altri due connessioni alle quali può essere connessa la borsa respiratoria o la mandata di un ventilatore. Una leva che può assumere due posizioni connette in maniera diversa le varie componenti del blocco in modo che si origini un parallel Lack o un sistema tipo Mapleson D, con cui risulta facile eseguire una ventilazione controllata. Alle connessioni per il ramo inspiratorio e espiratorio, può essere connesso un canestro di calce sodata con valvole unidirezionali, trasformando il sistema in un rotatorio. Vantaggio di questa soluzione è che il leveraggio permette di cambiare rapidamente la configurazione dall’utilizzo della borsa respiratoria all’utilizzo del ventilatore. Il sistema è flessibile e si adatta bene alle diverse esigenze cliniche. I maggiori difetti sono il costo esoso e, nella configurazione con calce sodata, il fatto che se il circuito è fissato all’uscita dei gas freschi, questa deve sopportare un peso rilevante.
Sistema Mapleson E con respirazione spontanea
Con questo sistema, i gas freschi arrivano in prossimità del tracheotubo, mentre il paziente inspira ed espira nel corrugato di maggior diametro. Quest’ultimo, nella versione originale, mancava della borsa respiratoria. Il sistema, che classicamente ricalcava lo schema sopradescritto, era il pezzo a T di Ayres, circuito ad uso pediatrico. Questo circuito prevedeva che i gas, a fine ciclo, fossero rilasciati direttamente nelle sale operatorie. Oggi giorno tale soluzione sarebbe, ovviamente, inaccettabile e quindi ha più senso parlare di pezzo a T modificato (Fig. 7), che con l’aggiunta di una borsa respiratoria e di una valvola APL ricalca esattamente lo schema del Mapleson D. Per il funzionamento, quindi, si rimanda alla descrizione già fatta per il suddetto tipo di sistema. In aggiunta è bene ricordare che il pezzo a T è utilizzato nel paziente neonatale o pediatrico a differenza del Bain. Le caratteristiche salienti sono lo spazio morto limitato, la scarsa trazione esercitata sul tracheotubo, il ridotto ingombro, la presenza della borsa respiratoria lontana dal paziente e, come il Bain, la facilità di utilizzo con ventilatori. Il nome proviene dal fatto che la connessione tra paziente, ramo inspiratorio/espiratorio e gas freschi forma una vera propria T, molto ravvicinata al paziente. L’arrivo dei gas freschi costituisce il ramo perpendicolare della T, e questa soluzione evita un’eccessiva sovrappressione espiratoria, nel caso in cui i gas fossero diretti verso la connessione con il paziente o una depressione da effetto Venturi, se fossero orientati nel verso opposto. Così come per altri circuiti sopradescritti, il volume del ramo inspiratorio/espiratorio deve essere di superiore al volume tidalico del paziente, pena la rirespirazione.
Ventilazione controllata con il pezzo a T
Prima dell’introduzione delle modifiche di cui sopra, la ventilazione controllata era effettuata dall’anestesista occludendo il ramo inspiratorio/espiratorio con il pollice, durante l’inspirazione e rilasciandolo nella fase espiratorio. Utilizzando il circuito modificato, l’anestesista opera esegue le stesse manovre discusse per il circuito di Bain. Similmente a quest’ultimo la ventilazione controllata permette d’imporre i tempi della ventilazione, rendendo il sistema più efficiente. Molti testi riportano che il FGF durante la respirazione spontanea può passare da 3 volte il volume tidalico a meno di 2 volte durante la ventilazione controllata. Tutti i circuiti pediatrici che hanno una APL dovrebbero averla con una pressione massima d’apertura inferiore ai 30 cmH2O, questo diminuirebbe i rischi di baro trauma. Vale la pena ricordare che le valvole APL, presenti su circuiti destinati a pazienti umani adulti, hanno una pressione di apertura intorno ai 60 cmH2O.
Pezzo a T con modifica di Jackson-Rees (sistema F Mapleson)
Questo sistema viene ricordato solo come fatto storico. Il circuito era disegnato come un Mapleson E a cui si aggiungeva una borsa respiratoria all’estremità del tubo inspiratorio/espiratorio. Il pallone era tagliato nella parte più stretta, per permettere ai gas di fuoriuscire. L’anestesista, una volta occlusa questa apertura, poteva ventilare manualmente il paziente. L’apertura del pallone poteva essere occlusa da una valvola connessa ad un tubo che convogliava i gas di scarico. La presenza della borsa permetteva anche di controllare visivamente l’attività respiratoria del paziente.
Sistema rotatorio (o circolare)
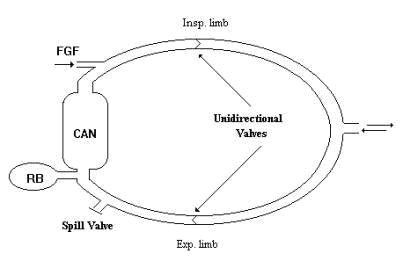
Il sistema rotatorio permette il riutilizzo della gran parte dei gas espirati, contenenti ossigeno, vapor acqueo, gas anestetico e calore. Tutto questo fa si che i gas inspirati siano composti, quindi, in parte da gas freschi in parte da gas già espirati. I vantaggi sono il risparmio d’anestetico e l’inalazione di gas già umidificati e riscaldati, inoltre lo spazio morto è solitamente limitato dalla presenza di valvole unidirezionali. Gli svantaggi sono l’ingombro (anche se i moderni carrelli d’anestesia hanno circuiti rotatori integrati), il maggior costo iniziale, la presenza di parti mobili (valvole unidirezionali) che possono andare incontro a malfunzionamenti, la necessità di sostituire periodicamente la calce sodata e una certa imprevedibilità della percentuale di gas anestetico inalato rispetto alle impostazioni del vaporizzatore. Un circuito rotatorio è composto da: due tubi corrugati (ramo inspiratorio ed espiratorio) che si connettono con un raccordo ad Y, due valvole unidirezionali (valvola inspiratoria ed espiratoria), un canestro contenente materiale atto ad asportare l’anidride carbonica dal gas espirato, una valvola espiratoria e una borsa respiratoria.
Come funziona?
Ognuna delle componenti sopra descritte può avere caratteristiche diverse in base all’utilizzo che si vuol fare del circuito. In linea generale l’aumento del volume interno del circuito diminuisce le resistenze al flusso inspiratorio o espiratorio, diminuisce i tempi di sostituzione del mezzo assorbente l’anidride carbonica e aumenta la quantità di anestetico richiesto per raggiungere l’equilibrio tra paziente e circuito. Quest’ultimo si traduce nel fatto che qualsiasi variazione della concentrazione di anestetico avverrà più lentamente e che quindi l’operatore dovrà aumentare la percentuale di anestetico presente nei gas freschi o/e incrementare il FGF.
Altro aspetto critico dei circuiti rotatori sono le valvole. Queste permettono ai gas di circolare unidirezionalmente all’interno del circuito, permettono anche di separare ciò che è gas espirato da ciò che è privo di anidride carbonica. Sono anche l’unico elemento mobile del circuito (al di là dei gas), quindi le loro dimensioni, il materiale con cui sono costruite e il fatto che siano verticali o orizzontali le rendono più o meno adatte ai diversi pazienti. Le caratteristiche meccaniche delle valvole sono importanti proprio perché determinano l’inerzia al movimento e di conseguenza il ritardo con cui si chiudono o si aprono con il conseguente sforzo da parte dei muscoli respiratori del paziente per azionarle. Qualsiasi situazione che renda la valvola meno mobile, può determinare serie conseguenze per il corretto funzionamento del circuito, con comparsa più o meno grave di rirespirazione. Ogni circuito rotatorio correttamente progettato dovrebbe consentire il controllo del movimento delle valvole durante il loro funzionamento e qualora necessitino degli interventi, la valvola dovrebbe essere smontata rapidamente.
La borsa respiratoria così come la valvola APL e l’arrivo dei gas freschi possono essere posti in posizione diversa all’interno del circuito. Questo fa si che le caratteristiche dei vari circuiti possano variare leggermente in base alle scelte compiute dal costruttore, per esempio se la borsa respiratoria sarà posta tra valvola espiratoria e canestro di calce sodata, la resistenza all’espirazione sarà bassa, ma durante la fase inspiratoria il paziente dovrà aumentare il proprio sforzo per far si che i gas passino attraverso il canestro, situazione invertita si verificherà quando la borsa sarà posta tra valvola inspiratoria e canestro. La valvola APL dovrebbe essere posizionata in prossimità della valvola espiratoria, così che sia il gas espirato a fuoriuscire piuttosto che il gas filtrato dalla calce sodata. Tuttavia non tutti i circuiti hanno questa accortezza, così può succedere che a fuoriuscire dall’APL siano gas già depurati dall’anidride carbonica se non, addirittura, gas freschi. Anche l’arrivo dei gas freschi può determinare effetti diversi in dipendenza a dove questo e localizzato. Per esempio qualora i gas dovessero attraversare la calce sodata per raggiungere la borsa respiratoria, sarebbe aumentata la probabilità di essiccamento della calce stessa con tutte le conseguenze che più sotto descriveremo. Anche l’entità del gas fresco può determinare alcune alterazioni nel funzionamento del circuito. Elenchiamo per esempio:
- Un elevato tasso di FGF aumenterà il flusso nella parte inspiratoria del sistema, diminuendo così qualsiasi resistenza alla inspirazione, ma aumenterà la resistenza espiratoria attraverso una maggiore resistenza all’apertura della valvola espiratoria e dell’APL.
- Il contrario si verifica con i flussi di gas bassi. FGF basso, aumenterà anche l'umidità relativa, aumentando così la “vischiosità” delle valvole unidirezionali a causa della condensazione del vapore acqueo, quindi aumentando ulteriormente la resistenza di flusso.
- Alti flussi inspiratori possono far si che le resistenze poste dal circuito aumentino sensibilmente, questo può causare lo sviluppo di considerevole depressione inspiratoria con conseguenze negative di vario genere. Questi fattori possono avere un effetto particolarmente deleterio in pazienti piccoli.
Tipicamente sono usati alti FGF nelle prime fasi dopo la connessione del paziente al circuito, gli alti flussi in questa fase hanno vari scopi:
- eliminare dal sistema l’aria e riempire il circuito con agenti anestetici e la percentuale voluta d’ossigeno;
- per fornire una quantità sufficiente di agenti inalatori per l'assorbimento alveolare (che è inizialmente è elevato);
Circuito “va e vieni” con calce sodata
Il va e vieni con calce sodata non è altro che un Mapleson C al quale sia stato interposto un piccolo canestro di calce sodata tra il gruppo composto da arrivo dei gas freschi, APL e connessione al paziente da una parte e la borsa respiratoria dall’altra (Fig. 10). Questo circuito è pensato per ridurre i consumi imposti da un va e vieni che funzioni come un Mapleson C, evitando l’ingombro di un circuito rotatorio, i potenziali problemi derivanti dall’uso delle valvole e fornendo una soluzione a basso costo. A fronte di questi vantaggi teorici nel suo complesso il circuito presenta molti limiti e rischi potenziali, che, nell’ottica di operare nella massima sicurezza, minimizzando, sconsiglia l’uso di tale circuito. I rischi legati all’uso di tale sistema sono innumerevoli: il canestro inserito nel circuito fa si che il suo peso possa gravare inaccettabilmente sul tracheotubo con conseguente lesione del laringe o della trachea del paziente; la polvere di calce sodata può raggiungere le vie aeree, con effetti caustici, data la vicinanza tra queste e il canestro; i canestri di piccole dimensioni possono andare incontro a tunneling che determinerebbe rirespirazione; il progressivo esaurimento della calce provoca l’aumento dello spazio morto del circuito. I potenziali rischi derivanti dall’uso di questo circuito e la presenza di alternative meno problematiche sconsiglia, l’uso di questi circuiti.
ASSORBIMENTO DELL'ANIDRIDE CARBONICA
L'anidride carbonica può essere rimossa dai gas esalati da una reazione chimica con composti assorbenti a base di varie basi metalliche (idrossidi). Questa reazione richiede la presenza di acqua in modo che queste basi e il biossido di carbonio (come acido carbonico) possa esistere in forma ionica.
Composizione chimica delle sostanze assorbenti
Il componente principale delle sostanze assorbenti, fatti da produttori diversi, è l’idrossido di calcio. Altri componenti sono aggiunti per migliorare la reattività di questo composto. Questi includono:
Idrossido di Sodio/Potassio. Piccole quantità di idrossido di sodio (1,5-5%) di solito sono aggiunti per migliorare la reattività e la proprietà igroscopiche (capacità di legare l'acqua) della miscela, da qui la ragione del fatto che le sostanze assorbenti sono spesso indicate come calce “sodata”. Alcuni produttori hanno aggiunto idrossido di potassio per ragioni analoghe, anche se questo è stato cessato (vedi sotto).
Bario. La cosiddetta baralime è costituita da 85% di idrossido di calcio, 11%, idrossido di bario e 4% di idrossido di potassio. L'idrossido di bario in combinazione con idrossido di calcio, non ha mai richiesto indurenti aggiuntivi. Tuttavia, i prodotti contenenti bario sono stati rimossi dal mercato nell'autunno del 2004.
Contenuto di acqua. Il contenuto di umidità ottimale della miscela assorbente è tra 14-16%. Ciò è essenziale per la reazione a catena che segue:
- CO2 + H20 = H+ + HCO3-
- 2NaOH + 2 (H+ + HCO3-)= Na2CO3+ 2H20 + hcalore
- Na2CO3 + Ca (OH)2 = CaCO3 + 2NaO
Nella seconda equazione, sodio può essere sostituito da potassio per gli assorbenti che contenevano idrossido di potassio.
La reazione è interessante in quanto:
- produce energia termica (si tratta di una reazione esotermica);
- cambia il pH del carbonato di calce, che permette l'uso dei coloranti indicatore che mostrano quando il carbonato di calce è esaurito;
- produce più acqua di quella usata nella reazione. Infatti, per ogni mole di biossido di carbonio assorbito una mole di acqua è prodotta.
Altri componenti
Zeolite. Le zeoliti sono sostanze di sintesi o naturali, microporose e cristalline cristallini che contengono alluminio, silicio e ossigeno nella loro struttura; cationi e acqua si trovano nei pori. Zeoliti hanno spazi vuoti (cavità o canali) che possono ospitare altre molecole. Possono essere aggiunti all’idrossido di calcio per aumentare:
- porosità della miscela. L'assorbente diventa più efficiente in più poroso, per l'aumento della superficie disponibile.
- durezza. Più duro è il composto, meno probabile è la formazione di polvere. La polvere se inalata è caustica. La polverepuò anche impastarsi con la condensa sulle varie strutture diventare umido e stabilirsi sulle valvole all'interno del sistema di respirazione e le fanno diventare appiccicoso.
- contenuto di acqua. Zeolite aiuta anche a prevenire l'essiccazione delle assorbente in condizioni avverse. Tuttavia, se ciò dovesse verificarsi, la zeolite può iniziare ad assorbire anestetico volatile, riducendo così la concentrazione dell’anestetico nel sistema di respirazione, soprattutto all'inizio dell’anestesia. Fino al 80% l'agente può essere assorbito in questa situazione
Silice. Idrossido di sodio e potassio sono sempre stati aggiunti per aumentare la reattività dei composti assorbenti e di fornire proprietà igroscopiche (ritenzione idrica). Tuttavia, essi sono la causa principale del degrado degli agenti anestetici in presenza di calce sodata secca (isofluorano/desflurane) che portano alla produzione di monossido di carbonio e la degradazione del sevoflurano a vari composti tra l’altro il composto A, formaldeide e metanolo. L’idrossido di calcio è stato originariamente pensato per essere sufficientemente reattivo per proprio conto e quindi essere adatto da solo a legare anidride carbonica. Tuttavia, nuovi metodi di produzione hanno portato alla produzione di granuli più porosi (vedi sopra), in modo che l’idrossido di calcio da solo possa ora essere sufficiente come assorbente. I granuli anche se sono molto meno duri, richiedendo l’aggiunta di materiali indurenti come la silice. I nuovi assorbenti hanno dimostrato di ridurre al minimo la produzione dei composti indesiderati sopra descritti, anche se secchi.
Cloruro di calcio. L'aggiunta del 3% di cloruro di calcio al posto di sodio o di potassio ha un effetto simile ma meno potente. Questo prodotto contiene anche 1% di solfato di calcio per migliorare la durezza del granulo. A differenza di assorbenti che contengono basi forti, ci può anche essere un cambiamento di colore (simile allo stato esaurito) su un campione dovrebbe secco. Anche qualora ci fosse un essiccamento di questa sostanza, ilmonossido di carbonio (con isoflurano e desflurano) o il composto A (con sevoflurano) non si verrebbero a formare.
Dimensione dei granuli
Le dimensioni dei granuli è importante. Un granulo troppo grande produce grandi lacune all’interno del canestro, con conseguente scarso contatto con i gas di passaggio, e la conseguente inefficiente assorbimento di anidride carbonica. Un granello troppo piccolo può fornire una resistenza alta al flusso del gas e una maggiore possibilità di formazione di polvere. La dimensione ottimale del granello è pensato essere tra 1,5 e 5 mm di diametro.
Produzione
Gli ingredienti sono mescolati in una pasta con aggiunta di acqua. Questa è trattata in diversi modi. In origine la pasta è asciutta e poi schiacciata tra rulli in modo che formino granuli. Il prodotto è poi essiccato e setacciato attraverso varie maglie per mantenere le dimensioni sopra citate. I granuli sono poi irrorati con acqua per dare il giusto contenuto d'acqua per permettere la reattività ottimale senza rendere il granello morbido o appiccicoso. Negli Stati Uniti sono forniti granuli di soda calcica tra il 4 e l'8 Mesh USP (2,36-4,75 mm). Nel Regno Unito i granuli sono forniti ad un BP (British Farmacopea) standard di 1,4-4,75 m (3-10 Mesh). Più di recente, sono stati introdotti dei metodi di produzione che rendono le dimensioni del granulo più uniforme. La pasta può essere anche spremuta attraverso un setaccio come gli spaghetti e tagliati a pezzetti. Può essere passato attraverso un rullo che ha migliaia di fossette sulla sua superficie. Questo produce minuscole sfere di dimensioni simili che si separano dal rullo da un getto ad alta pressione d'aria.
Capacità di assorbimento della soda calcica
La calce sodata è in grado di assorbire 25 litri di anidride carbonica per 100 g, e quella con bario, 27 litri di anidride carbonica per 100 g. Tuttavia, in uso continuo, il carbonato di calce appare esaurito (come indicato dal cambiamento di colore) prima che queste capacità vengano raggiunte, in quanto la parte esterna del granulo si esaurisce prima che il granello sia completamente esaurito. Inoltre, il tempo di contatto tra composto assorbente e l’anidride carbonica influisce sull'efficienza dell’assorbente stesso. Più canestri, contenenti 500 g di calce sodata, appaiono esausti a un carico di anidride carbonica di 10-12 litri per 100 g. Grandi assorbitori contenenti 2 kg (Jumbo) di calce sodata, che consentono un più lungo tempo di contatto tra il biossido di carbonio e assorbente, sembrano esauriti con un carico di anidride carbonica di 17 litri per 100 g.
Quando il sistema viene lasciato riposare per qualche ora, il carbonato di calce sembra rigenerarsi, dato che la superficie di carbonato viene diluita dalla migrazione di ioni idrossido dall’interno del granulo. Il colore della calce sodata fresca dipende da quale colorante indicatore è stato aggiunto dal produttore. Per esempio, se è aggiunto il ‘titan yellow’, la soda sarà rosa intenso quando è nuova e bianca quando esaurita, mentre se è utilizzato l’“ethyl violet” come colorante indicatore, il carbonato di calcio, in questo caso, cambia dal bianco, quando è fresco, a viola, quando esaurito. Alcuni assorbenti hanno un pigmento verde aggiunto all’ethyl violet, in modo che sia verde chiaro quando è fresco, ma viola quando esausto.
La reazione esotermica
Il calore e l'acqua prodotta dalla reazione tra calce sodata e anidride carbonica, è stata considerata vantaggiosa in quanto (a basso flusso) fornisce gas inspiratorio umidificato e caldo e umidità. La temperatura e l'umidità del gas inspirato è collegato a una serie di fattori:
- se il tasso di FGF è alto, il gas secco che entra nel sistema riduce sia l'umidità e la temperatura dei gas di ricircolo;
- a FGF bassa, se il tempo di circolazione di gas è alta, l'umidità e la temperatura aumenta;
- più a lungo il sistema è in uso a FGF basso, maggiore è l'umidità e la temperatura dei gas di circolazione; il calore prodotto, tuttavia, non è necessariamente sempre benefico. La reazione chimica è aumentata tra anestetici volatili e assorbenti tradizionali in proporzione alla temperatura all'interno del sistema: il tricloroetilene può essere decomposto a dicloroacetilene (che è neurotossico) e in seguito a fosgene, se la temperatura all'interno della calce sodata calcica supera i 60° C. Gli agenti anestetici con la frazione di CHF2 (desflurane, enflurano e isoflurano) reagiscono con calce sodata asciutta e calda per produrre quantità variabili di monossido di carbonio.
La cosiddetta baralime, contenendo idrossido di potassio, ha una tendenza molto maggiore alla produzione di monossido di carbonio di quanto non faccia la calce sodata che contiene idrossido di sodio. La calce sodata quando contiene circa il 15% di contenuto di acqua sembra impedire la formazione di monossido di carbonio.
In effetti, una produzione significativa si verifica solo quando il contenuto d'acqua è inferiore al 2%. Questo problema può verificarsi quando l'assorbente è lasciato ad asciugare. Questo accade quando il sistema di respirazione viene lasciato inutilizzato per lunghi periodi, o quando grandi quantità di gas secco attraversano di la calce per lungo tempo. Ciò può verificarsi con alcune macchine d’anestesia, anche se i misuratori di flusso sono spenti, se:
- la macchina è rimasta connessa con la linea di fornitura dei gas;
- hanno un flusso minimo basale di ossigeno attraverso la macchina;
- l'assorbitore è costruito in modo che il gas fresco venga fatto fluire attraverso l'assorbente prima di entrare nell’inspiratorio;
Il monossido di carbonio non è facilmente misurabile come gas esalato dalla macchina d’anestesia. La sua produzione e assorbimento da parte del paziente è difficile da rilevare. Non vi è necessariamente un cambiamento di colore delle sostanze assorbenti contenenti basi forti (potassio / sodio) una volta asciutte. Il sospetto dovrebbe essere sollevato qualora si registri una produzione eccessiva di calore da parte della calce sodata. Questo fenomeno può essere facilmente evitato:
- con canestri piccoli (in modo che siano cambiati regolarmente);
- scollegando macchine d’anestesia o i canestri, in particolare quando si presuma il loro mancato utilizzo per periodi prolungati;
- evitando di disegnare i circuiti in maniera tale che i gas freschi attraversino la calce sodata prima di venire utilizzati;
Il sevoflurano può essere degradato, all'interno dell’assorbitore, dando origine a prodotti non tossici fluorurati (soprattutto il “composto A”). I livelli di questo composto aumentano quando la concentrazione dell'agente è elevata, in anestesie prolungate, quando il FGF è basso e all’aumento della temperatura di funzionamento dentro l’assorbitore. Tuttavia, non vi è alcun evidente pericolo per i pazienti.
Bibliografia
- ConwayCM (1986). Gaseous homeostasis and circle system. BJA 58(3): 337-44.
- Cook LB (1996) Mapleson breathing systems. The importance of the of the respiratory pause. Anaesthesia 51: 435-460.
- Davey AJ (2005). Breathing systems and their components. In Ward’s (5thEd): Anaesthetic equipments. Elsevier Limited pp: 131-64.
- Dorrington KL (1996). The Mapleson breathing systems. Anaesthesia 51(10): 988.
- Dorrington KL, Lehn JR (1989). Rebreathing during spontaneous and controlled ventilation with “T” piece breathing systems: a general solution. Anaesthesia 44: 300-2.
- Mapleson WW (1998) The elimination of rebreathing in various semi-closed anaesthetic systems. BJA 80(2): 263-269.
- Miller DM (1996). Brathing systems reclassified. Anaesthesia in Intensive Care 23(3): 281-3.
- Murray JM, Renfrew CW, Bedi A, McCrystal CB, Jones DS, Fee JP Amsorb. A new carbon dioxide absorbent for use in anaesthetic breathing systems. Anesthesiology 91(5): 1342-8.
- Spoerel WE, Bain JA (1986). Anaesthetic breathing systems. BJA 58(7): 819-21