Feromoni: gatto
Anche se le strutture che secernono i feromoni sono tuttora poco conosciute, sembra essere assodato che la loro produzione e secrezione sono involontarie. Nei carnivori i feromoni sono escreti da differenti strutture ghiandolari distribuite nell’epidermide e nelle mucose attorno agli orifizi naturali. Le principali strutture secernenti ne...
Criceto russo (Phodopus campbelli)
Spesso viene erroneamente venduto come lemming, una specie del tutto diversa (Lemmus lemmus). E’ più piccolo del criceto dorato, anche se la struttura del corpo è simile. (Fig. 1) Origina dalle steppe di Russia, Siberia e Mongolia, zone a clima freddo, possiede infatti una pelliccia molto folta. E’ grigio con una striscia dorsale più scur...
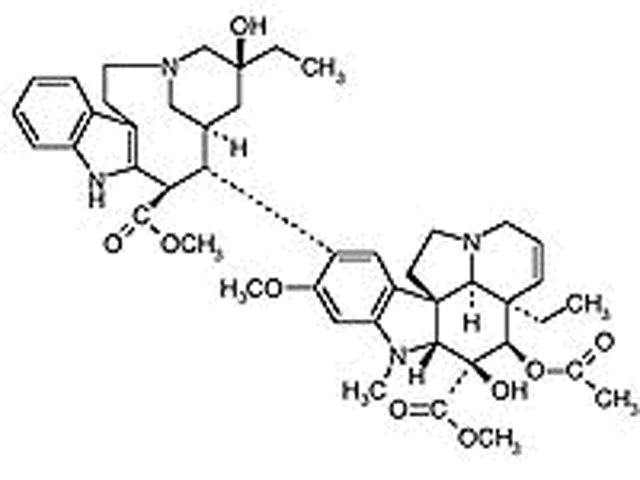
Vinblastina
La vinblastina appartiene agli alcaloidi della vinca, ed è un prodotto naturale della pervinca (Vinca minor). La vinblastina è un analogo chimico della vincristina. È composta da un anello di vindolina connesso ad un anello di catarantina per mezzo di legami carbonio-carbonio. All’anello di vindolina è attaccato un gruppo metilico. La ...
Calicivirosi felina
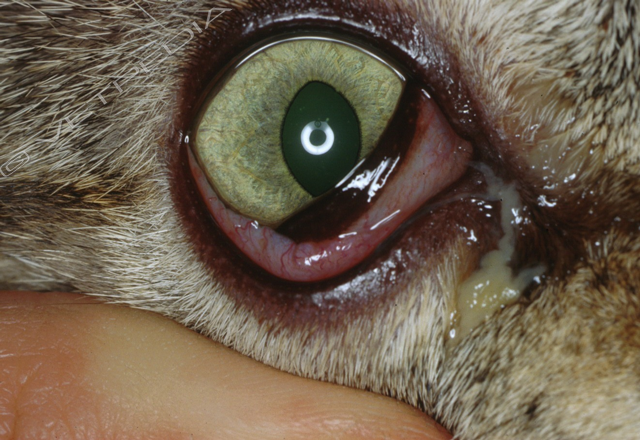
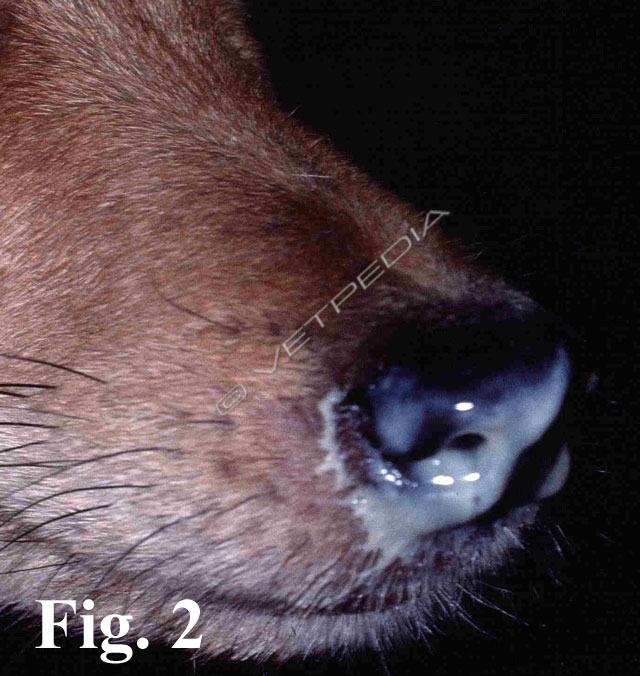
Il Calicivirus felino (FCV: Feline Calicivirus), agente eziologico della calicivirosi, è uno dei patogeni più comunemente associati al complesso delle infezioni delle prime vie respiratorie (U.R.T.D.= Upper Respiratory Tract Disease) del gatto (Gaskell et al., 1994). FCV appartiene alla famiglia Caliciviridae genere Vesivirus. Si tratta d...
Cimurro canino: prevenzione e profilassi
L’infezione sostenuta dal virus del cimurro (Canine Distemper Virus, CDV) è ampiamente distribuita in tutto il mondo ed è caratterizzata da elevata morbilità in soggetti non protetti ed elevata mortalità per lo sviluppo di problemi respiratori, gastroenterici e/o neurologici. La prevenzione del cimurro è principalmente medica e si basa su...
Invecchiamento (medicina comportamentale)
L’invecchiamento è un processo fisiologico che interessa tutti gli esseri viventi e si manifesta con modificazioni sia delle funzioni cellulari, tessutali e organiche sia delle risposte comportamentali. L’invecchiamento interviene disorganizzando l’insieme dei comportamenti, facilitando la comparsa di alterazioni cognitive ed emozionali e...
Costipazione delle ghiandole sebacee nella cavia
Le ghiandole presenti nella cute perianale possono andare incontro a costipazione, causando irritazione cutanea e accumulo di materiale maleodorante che può anche provocare l’ostruzione dell’ano. La terapia consiste nella pulizia regolare della zona con un detergente delicato o con gel per la disinfezione delle mani a base alcolica. &nbs...
Cheratocongiuntivite secca del cane
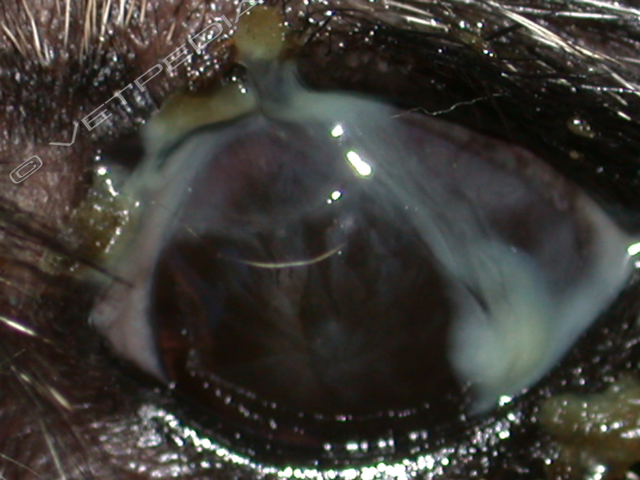
Con il termine cheratocongiuntivite secca si intende una insufficiente produzione della componente acquosa del film lacrimale che determina infiammazione della congiuntiva e della cornea con sintomatologia che si presenta estremamente polimorfa. SINTOMATOLOGIALa sintomatologia della cheratocongiuntivite secca è variabile e dipend...
Propofol
Il propofol è diventato oramai l’anestetico iniettabile più utilizzato sia in campo umano che in quello veterinario. Nei primi anni ‘70 furono condotti alcuni studi sui derivati del fenolo che portarono allo sviluppo di una nuova molecola con proprietà ipnotiche: il 2,6 diisopropilfenolo. Le prime sperimentazioni cliniche riportate da Kay...
Protocolli chemioterapici per il trattamento del linfoma nel cane
Schemi di polichemioterapia per il trattamento del linfoma ad alto grado nel cane. TRATTAMENTO DI PRIMA LINEA DEL LINFOMA AD ALTO GRADOCOP: induzione e mantenimento Farmaco Protocollo a basse dosi Protocollo ad alte dosi Ciclofosfamide 50 mg/m2 PO a giorni alterni per 8 settimane, oppure 50 mg/m2 PO per 4...