[{{{type}}}] {{{reason}}}
{{/data.error.root_cause}}{{{_source.title}}} {{#_source.showPrice}} {{{_source.displayPrice}}} {{/_source.showPrice}}
{{#_source.showLink}} {{/_source.showLink}} {{#_source.showDate}}{{{_source.displayDate}}}
{{/_source.showDate}}{{{_source.description}}}
{{#_source.additionalInfo}}{{#_source.additionalFields}} {{#title}} {{{label}}}: {{{title}}} {{/title}} {{/_source.additionalFields}}
{{/_source.additionalInfo}}Shock
- Disciplina: Medicina d'urgenza
- Specie: Cane e Gatto
Lo shock è la conseguenza di un deficit della perfusione tissutale responsabile di un’insufficiente ossigenazione, di un ridotto apporto di principi nutritivi e di un accumulo di metaboliti che causano danni cellulari. In corso di shock la disponibilità di ossigeno (DO2) è ridotta a seguito delle alterazioni emodinamiche e della riduzione del contenuto totale di ossigeno. Il mancato apporto di principi nutritivi alla cellula è responsabile di una ridotta sintesi di adenosina trifosfato (ATP) a livello mitocondriale con conseguente riduzione di energia disponibile per tutte le sue funzioni. La riduzione dell’energia disponibile e l’alterazione della perfusione tessutale ostacolano la normale rimozione dei cataboliti prodotti dall’attività cellulare.
Indipendentemente dall’eziologia, lo shock non è riconducibile ad un unico problema fisiopatologico, ma ad un dinamico insieme di alterazioni cellulari, di organi e apparati che possono essere coinvolti in modi e tempi differenti. Per questi motivi non esiste un unico farmaco in grado di trattare lo shock ma è necessario riconoscerne il tipo e lo stadio per poter effettuare una terapia efficace. Le alterazioni causate dallo shock se gravi e protratte per ore o peggio per giorni possono essere responsabili della morte del paziente.
FISIOPATOLOGIA
Le conseguenze prodotte dallo shock sono:
- deficit di ossigeno
- deficit dei fabbisogni nutritivi
- accumulo di metaboliti
La risposta dell’organismo agli eventi stressanti come ad esempio un’intensa attività sportiva è simile alle alterazioni fisiopatologiche che si realizzano in corso di shock. Dopo uno sforzo intenso, è possibile riscontrare l’aumento della frequenza cardiaca e respiratoria, la vasocostrizione periferica e la deviazione del volume circolante verso gli organi vitali quali polmone cuore e cervello, gli stessi segni sono comuni a molte forme di shock. La risposta endocrina e metabolica sono molto simili, ciò che cambia è l’entità della risposta e la sua durata nel tempo. Un evento stressante può perciò evolvere in shock a seguito del perdurare nel tempo dello stimolo o quando l’evento stressante è tanto grave da indurre una risposta da parte dell’organismo incompatibile con la vita per entità e durata.
L’ipotalamo, che non è controllato dalla neocorteccia e perciò è indipendente dalla volontà, a seguito della stimolazione indotta dalle citochine (CK) liberate nel sito del trauma o deve esiste una sofferenza tessutale, adotta una risposta che può essere rapida, promuovendo la liberazione di catecolamine ed ormone antidiuretico (ADH, secreto dalla neuroipofisi) oppure modulare una risposta più lenta attraverso la liberazione di fattori di rilascio. I fattori di rilascio attraverso il circolo portale raggiungono l’adenoipofisi dove inducono la liberazione di ormoni come la corticotropina e l’ormone della crescita. Il deficit di perfusione tessutale e la ridotta disponibilità di ossigeno a livello cellulare, stimolano un ulteriore rilascio di CK, e inducono la liberazione del fattore di necrosi tessutale (TNF) e di interleuchine.
Le CK causano ipotensione e riducono la contrattilità miocardica, aumentano la frequenza cardiaca e respiratoria ed aggravano l’acidosi lattica, promuovono l’adesione tra leucociti e l’endotelio, richiamano altre CK, attivano i neutrofili ed inducono il rilascio di IL-6, quest’ultima attiva altre cellule infiammatorie tipiche delle fase acuta. Le CK stimolano inoltre l’attivazione delle piastrine le quali inducono rilascio di istamina, serotonina, broncocostrizione, aumento della permeabilità capillare e riduzione della pressione arteriosa. L’attivazione dei leucociti ad opera delle CK causa danno endoteliale con aumento della permeabilità vascolare e trombosi, l’aumento della adesività dei leucociti contribuisce alla occlusione microvascolare.
Il TNF che si libera nei tessuti ischemici dove la perfusione e la DO2 è insufficiente causa anche una depressione della contrattilità miocardica. Il sangue, a seguito della vasocostrizione periferica, é deviato verso gli organi vitali (cuore e cervello) causando una ipoperfusione di: reni, fegato, tratto gastroenterico e polmoni. L’ipoperfusione se prolungata può causare insufficienza renale acuta con acidosi metabolica, necrosi tubulare acuta e glicosuria, a livello gastroenterico possono svilupparsi ulcere che facilitano le traslocazioni batteriche e sepsi mentre a livello polmonare la vasocostrizione altera il rapporto ossigenazione/perfusione ostacolando l’ossigenazione ematica. Se il processo non è corretto da una terapia opportuna si possono sviluppare insufficienze d’organo multiple (MODS) e morte del paziente.
CLASSIFICAZIONE
Identificando lo squilibrio principale, lo shock può essere classificato in tre tipi principali:
- ipovolemico
- distributivo
- cardiogeno
Nello shock ipovolemico lo squilibrio principale è la perdita di volume circolante, in quello cardiogeno è l’insufficienza cardiaca ed in quello distributivo sono le alterazioni circolatorie. Nello stesso paziente si possono presentare più tipi di shock contemporaneamente, ad esempio un paziente cardiopatico può subire un trauma e presentare una grave emorragia che causa uno shock ipovolemico responsabile di un aggravamento dello scompenso cardiaco con conseguente contemporanea presenza di uno shock cardiogeno. Diagnosticare il tipo di shock ed il suo stadio è necessario per poter eseguire una diagnosi del processo morboso in atto ed eseguire una pronta terapia efficace, tale diagnosi si effettua valutando almeno i seguenti parametri vitali:
- colore delle mucose e tempo di riempimento capillare
- polso e sue caratteristiche
- frequenza cardiaca e toni
- frequenza respiratoria e modello ventilatorio
- temperatura centrale e periferica (rettale e interdigitale)
- stato del sensorio
L’analisi di tali parametri vitali permette di valutare l’efficacia della ventilazione, del circolo e la coscienza del paziente. I pazienti in stato di shock possono avere uno o più parametri alterati, l’entità dell’alterazione e la quantità di parametri alterati indicano la gravità del processo morboso e il suo stadio. Quando possibile oltre alla rilevazione dei parametri vitali clinici sopra menzionati, dovrebbe essere sempre misurata la pressione arteriosa per stabilire il tipo fluidoterapia rianimatoria. I pazienti ipovolemici che presentano una pressione arteriosa media inferiore a 70 mmHg o una pressione arteriosa sistolica inferiore a 90-100 mmHg necessitano di un rapido ripristino del circolo con una fluidoterapia aggressiva (definita appunto “dose shock”).
Dopo la rilevazione dei parametri vitali, quando si diagnostica una insufficienza cardiocircolatoria può essere utile misurare la lattatemia per quantificare oggettivamente la perfusione tessutale. La lattatemia è utile anche nelle ore o giorni successivi per verificare l’efficacia della terapia adottata, una corretta terapia è in grado di ridurne i valori già dopo un’ora dall’inizio del trattamento. La misurazione della lattatemia può essere effettuata da un campione di sangue periferico (se non esiste una grave compromissione del circolo locale) o meglio centrale. I campioni di origine centrale sono altresì utili per valutare la saturazione venosa centrale (SVO2) la quale fornisce informazioni circa la capacità dell’organismo di ossigenare i tessuti (per quantificarla è necessaria però un’emogasanalisi). La SVO2, è uno dei parametri utilizzati nell’uomo per valutare l’efficacia della terapia in corso di sespi e shock settico. Un’altra indagine molto utile durante la prima valutazione del paziente è la misurazione della saturimetria da una mucosa esplorabile (per esempio labbro o lingua). La saturimetria indica la capacità dei polmoni e del circolo di ossigenare il sangue, fornisce i dati in tempo reale e in modo continuativo utili anche per valutare l'efficacia della terapia adottata istante per istante.
Lo shock ipovolemico può essere causato da emorragie, vomito o diarrea gravi, perdita di fluidi nel terzo spazio e più raramente ipoadrenocorticismo. I pazienti in stato di shock ipovolemico presentano mucose pallide o biancastre, ciò dipende dalla gravità dell’ipovolemia e dalla vasocostrizione o vasodilatazione periferica. La vasocostrizione periferica è responsabile di un prolungamento del tempo di riempimento capillare (TRC) perchè il sangue necessita di un tempo maggiore per riempire il letto vascolare della mucosa quando esso è stato rimosso dalla compressione digitale. La vasocostrizione periferica che devia il sangue dalla muscolatura, cute e dal tratto gastroenterico verso cuore e cervello, nello shock ipovolemico, è conseguente alla stimolazione dei barocettori presenti nell’aorta e nella carotide i quali percepiscono un minore distensione della parete vasale ed inviano segnali al centro vaso motore che si trova nel midollo allungato il quale inibisce il sistema nervoso parasimpatico. La riduzione del tono vagale oltre alla vasocostrizione periferica, causa anche un aumento della frequenza cardiaca e della contrattilità miocardica. I barocettori stimolano anche il rilascio di ormone antidiuretico (ADH) o vasopressina dalla neuroipofisi, la quale causa ritenzione idrica a livello dei tubuli contorti distali renali. La vasocostrizione, se prolungata provoca riduzione di temperatura delle estremità e acidosi tessutale come conseguenza della riduzione dell’ossigeno disponibile rispetto alle necessità (VO2). La riduzione del volume circolante riduce il volume di eiezione ventricolare (SV= volume di sangue espulso dal ventricolo sinistro durante ogni sistole), causando una diminuzione della gittata cardiaca, della disponibilità di ossigeno e aumento della mortalità. Un’eccessiva vasodilatazione periferica come quella che si riscontra nello stadio terminale dello shock può produrre un prolungamento del TRC a causa della eccessiva dilatazione dei capillari periferici. Nello shock ipovolemico, è di comune riscontro l’aumento della frequenza cardiaca perchè l’organismo cerca di compensare la riduzione dell’SV aumentando la il numero di eiezioni ventricolari per minuto. La gittata cardiaca (dall’inglese cardiac output o CO) è infatti il prodotto del SV per la frequenza cardiaca (HR) e si calcola con la seguente formula: CO = SV x HR. L’aumento della frequenza respiratoria comunemente presente negli stati di shock è in genere dovuta agli aumentati fabbisogni di ossigenazione dei tessuti poco o mal perfusi. Lo stato del sensorio può essere normale, depresso e nei casi molto gravi stuporoso come conseguenza della alterata perfusione e ossigenazione cerebrale. In alcuni casi i pazienti possono manifestare un sensorio eccitato conseguente alla stimolazione algica e alla liberazione di catecolamine quali l’adrenalina e la noradrenalina. Le catecolamine, oltre all’effetto vasomotorio, stimolano le cellule dell’apparato juxtaglomerulare del rene dove promuovono la liberazione di renina, la quale attiva il sitema renina-angiotensina-aldosterone con formazione di angiotensina II, la quale induce vasocostrizione splancnica e liberazione di aldosterone con riassorbimento di sodio e cloro. L’angiotensina II causa anche la liberazione di noradrenalina da parte dei surreni e dei neuroni del sistema nervoso simpatico.
I pazienti affetti da shock distributivo hanno una sintomatologia paragonabile a quella descritta per l’ipovolemico, per effettuare una diagnosi corretta è necessario diagnosticare l’origine del processo morboso (per esempio trauma e sepsi). Una menzione particolare merita lo shock settico il quale è caratterizzato da una ipotensione refrattaria ad una adeguata fluidoterapia di rianimazione. L’ipotensione, in questo tipo di shock, è conseguente all’attivazione dei canali del potassio, all’aumento della concentrazione di ossido nitrico e alla riduzione della concentrazione di vasopressina, la contrattilità miocardica è ridotta per effetto delle CK infiammatorie.
Lo shock cardiogeno può essere la conseguenza di un’insufficienza cardiaca anterograda o retrograda. Le insufficienze anterograde si verificano quando per cause cardiache (ad es. miocardiopatia dilatativa canina e felina, dotto arterioso pervio, stenosi della subaortica) si riduce la CO, le insufficienze retrograde (ad es. endocardiosi mitralica, difetti del setto ventricolare, endocardiosi della tricuspide) causano un aumento della pressione venosa con conseguente edema (polmonare o splancnico). I pazienti affetti da shock cardiogeno di origine anterograda possono avere una sintomatologia paragonabile allo shock ipovolemico in quanto si riduce la CO, mentre nei pazienti con insufficienza cardiaca retrograda hanno in genere un aumento della pressione arteriosa e possono manifestare edema polmonare o versamento addominale a seconda della valvola prevalentemente coinvolta.
E’ di fondamentale importanza distinguere lo shock cardiogeno di origine anterograda da quello ipovolemico, in quanto una fluidoterapia aggressiva, che può essere utile per lo shock ipovolemico, può essere deleteria nello shock cardiogeno di origine anterograda. Anche in corso di shock cardiogeno di origine retrograda una fluidoterapia aggressiva può causare un aggravamento della sintomatologia e un aumento del rischio di morte (per aggravamento dell’edema interstiziale e cellulare). Diagnosticato lo shock cardiogeno è necessario distinguere di quale insufficienza cardiaca si tratta poiché mentre il retrogrado spesso beneficia di una terapia con diuretici nell’anterogrado l’impiego di tali farmaci può compromettere la già deficitaria CO con conseguente riduzione della DO2 e aumento del rischio morte.
Diagnosticato il tipo di shock è necessario riconoscerne lo stadio per poter effettuare una terapia opportuna sia nei tempi che nella sua entità, e monitorare il paziente durante il ricovero. La valutazione dello stadio ed il suo monitoraggio sono utili anche ai fini prognostici e per segnalare al proprietario il carattere d’emergenza delle cure da prestare o viceversa la stabilità del paziente.
STADIAZIONE
Si possono riconoscere tre stadi dello shock: compensato, scompensato e terminale. I sintomi dello stadio compensato dello shock sono caratteristici di una fase iperdinamica influenzata dalla liberazione delle catecolamine e sono:
- aumento frequenza cardiaca
- pressione arteriosa normale o aumentata
- aumento dell’intensità del polso (polso iperdinamico)
- aumento della frequenza respiratoria
- mucose iperemiche
- riduzione del tempo di riempimento capillare (< 2 sec)
- aumento della differenza tra temperatura centrale e periferica
- eccitazione del sensorio
Nello stadio scompensato, si verifica una ridotta perfusione tessutale, con conseguente ipossia cellulare ed incremento del metabolismo anaerobio con produzione di acido lattico e incremento della lattatemia. La presenza di CK infiammatorie è responsabile della perdita di integrità della parete vascolare con conseguente riduzione della pressione arteriosa e perfusione tessutale. In questo stadio, la cute, l'apparato gastroenterico, i muscoli, i reni, il fegato, e i polmoni subiscono una minor perfusione per favorire cuore e encefalo. In questo stadio aumenta il rischio di ulcere gastroenteriche, insufficienza renale e traslocazione batterica.
I sintomi associati allo stadio scompensato sono:
- aumento della frequenza cardiaca
- riduzione della pressione arteriosa
- polso debole o difficile da percepir
- mucose pallide
- frequenza respiratoria aumentata o ridotta
- tempo di riempimento capillare prolungato (> 2 sec)
- estremità e cute fredde
- riduzione della temperatura rettale
- abbattimento del sensorio
Lo stadio terminale dello shock può essere la conseguenza di un’inefficace terapia o della insufficiente risposta del paziente a seguito del protrarsi dello stato di shock e alla continua presenza nel circolo delle CK con drastica riduzione della DO2 e possibile morte cellulare in alcuni tessuti e organi. In questo stadio è possibile riscontrare l’insufficienza di uno o più organi (sindrome da insufficienza d’organo multipla). La prognosi è sfavorevole con elevato rischio di arresto respiratorio e cardiaco imminente.
I sintomi associati allo stadio terminale sono:
- riduzione della frequenza cardiaca
- grave ipotensione
- tempo di riempimento capillare aumentato o difficile da determinare
- polso debole o assente
- riduzione dell’itto cardiaco
- mucose cianotiche o biancastre
- frequenza respiratoria ridotta, insufficienza ventilatoria
- riduzione della gittata cardiaca
- oliguria e insufficienza renale
- grave depressione del sensorio, stupore o coma.
TERAPIA
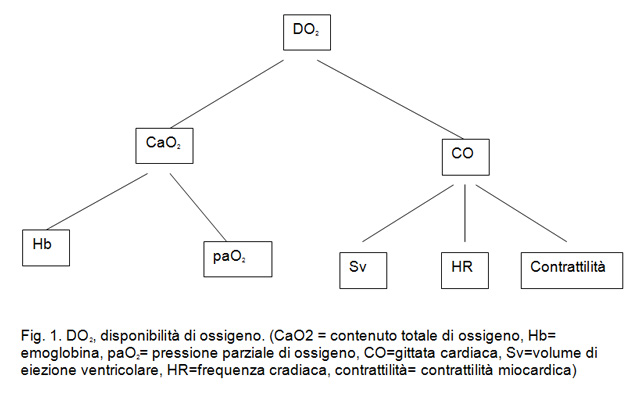
Per aumentare la sopravvivenza nei pazienti affetti da shock è necessario cercare di aumentare la DO2 ottimizzando la gittata cardiaca e il contenuto totale di ossigeno nel sangue (CaO2). La DO2 è influenzata da due componenti principali: la CO e il CaO2 (Fig. 1).
La CO dipende dall’SV, dalla frequenza cardiaca e dalla contrattilità del miocardio. Il CaO2 dipende dalla quantità di emoglobina e dalla pressione parziale di ossigeno arterioso (paO2). Purtroppo per quantificare la componente emodinamica della DO2, ossia la CO, è necessario posizionare un catetere a termodiluizione (catetere Swan Ganz) nell’arteria polmonare. Conoscendo però le componenti della CO e valutando i parametri clinici che la influenzano possiamo ottimizzarla con una terapia opportuna. La prima componente della CO, lo SV è dipendente dal precarico ossia dal volume ematico circolante che arriva al cuore destro e che clinicamente può essere valutato attraverso lo studio della volemia (ad esempio osservando l’ectasia della vena giugulare) e quantificato approssimativamente misurando la pressione venosa centrale. Il catetere venoso centrale può essere posizionato nella vena cava craniale attraverso la vena giugulare o la vena safena mediale.
Per incrementare la volemia è possibile somministrare fluidi per via endovenosa, mentre per ridurla generalmente si ricorre ai diuretici come ad esempio in corso di ipervolemia ed edema polmonare da insufficienza cardiaca retrograda. La frequenza cardiaca e la contrattilità possono essere sostenute con l’utilizzo di farmaci che controllano il ritmo e l’inotropismo cardiaco. Per quantificare la componente che concerne l’ossigenazione ossia la CaO2, è necessario eseguire un’emogasanalisi (EGA) arteriosa. L’EGA deve essere di origine arteriosa in quanto per calcolare il CaO2 è necessario conoscere il valore della pressione parziale dell’ossigeno e la sua saturazione nel distretto arterioso come indicato nella seguente formula:
CaO2= (1,3 x Hb x SaO2) + (0,03 x PaO2)
(CaO2 = contenuto totale di ossigeno, Hb= emoglobina, PaO2= pressione parziale di ossigeno arterioso)
Analizzando la formula si comprende quanto il CaO2 sia notevolmente influenzato dalla quantità di emoglobina presente nel sangue del paziente, perciò se si vuole incrementare la sopravvivenza nei pazienti in stato di shock è necessario cercare di avere valori di emoglobina maggiori o uguali a 7-8 g/dl o meglio superiori a 9-10 g/dl.
La terapia dello shock, indipendentemente dall’eziopatogenesi, si può quindi sintetizzare nell’acronimo VIP: ventilazione, infusione e perfusione.
Ventilazione. E’ necessario che il paziente si ventili e si ossigeni adeguatamente così da ottenere una valore della DO2 compresa tra 600-900 l/m2/min. Se il paziente non respira, è necessario effettuare una intubazione orotracheale ed eseguire due lunghe insufflazioni con ossigeno al 100% per espandere efficacemente il torace. Se il paziente non riprende la ventilazione spontanea è necessario eseguire la rianimazione cardiopolmonare cerebrale. Se il paziente si ventila spontaneamente è necessario verificare il livello di ossigenazione:
- normale: paO2 ≥ 80 mmHg, SaO2 ≥ 95%
- ipossiemia: paO2 < 80 mmHg, SaO2 < 95%
- ipossiemia grave: paO2 < 40 mmHg, SaO2 < 75%
(paO2 = pressione parziale di ossigeno nel sangue espressa in mmHg, SaO2 = percentuale di saturazione dell’emoglobina ossigenata)
Quando si diagnostica una ipossiemia è necessario somministrare ossigeno, di seguito sono riportati alcuni esempio di ossigenoterapia:
- maschera ossigeno: 5-6 litri al minuto.
- via endonasale: 50-100 ml/kg/min.
- transtracheale: 50-100 ml/kg/min.
- gabbia a ossigeno: mantenere FiO2 (frazione di ossigeno inspirata) al 40%.
- fonte di ossigeno (tubo) in prossimità cavità nasali (flow by):
- gatti e cani di taglia piccola 1-3 litri/min.
- cani di taglia media 3-5 litri/min.
- cani di taglia grande e gigante 5-15 litri/min
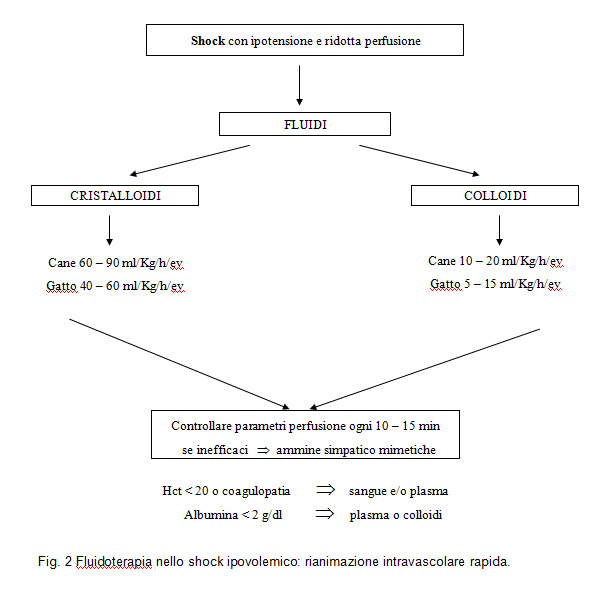
Infusione. Quando i pazienti affetti da shock hanno un volume circolante non sufficiente ad assicurare una buona gittata cardiaca è necessaria una fluidoterapia aggressiva per ripristinare un circolo efficace. In alcuni casi, quando il letto vascolare non è adeguato al volume circolate (ad esempio vasodilatazione conseguente a sepsi grave o shock settico) può essere utile associare alla fluidoterapia la somministrazione di farmaci vasoattivi (ad es. dobutamina, dopamina o noradrenalina). Per ripristinare rapidamente una circolazione efficace é possibile somministrare soluzioni cristalloidi ad alta velocità quali ad esempio NaCl 0,9%, Ringer lattato (LRS) e soluzione elettrolitica di reintegrazione con sodio gluconato (Normosol R). In corso di acidosi metaboliche le soluzioni preferite sono quelle bilanciate come la soluzione elettrolitica di reintegrazione con sodio gluconato o la Ringer Lattato. La velocità di infusione delle soluzioni cristalloidi in corso di shock ipovolemico, conosciuta anche come “dose shock”, è di 40-90 ml/kg/ora/ev/io nel cane e 25-55 ml/kg/ora/ev/io nel gatto (Fig. 2).
i cristalloidi abbandonano il letto vascolare con rapidità (dopo circa un’ora solo il 15-25% rimane nello spazio intravascolare) e possono provocare edemi interstiziali ed intracellulari soprattutto a livello polmonare e cerebrale. Le soluzioni cristalloidi ipertoniche (ad es. NaCl 7%) quando utilizzate per ripristinare rapidamente il circolo si somministrano a 4-5 ml/kg/ev/bolo/die, mentre le soluzioni colloidali (es. tetrastarch, destrano 70) a 10-20 ml/kg/ev/bolo/die. I colloidi sono preferiti ai cristalloidi quando si vuole ripristinare rapidamente il circolo o quando la pressione oncotica è ridotta, come ad esempio quando le proteine totali sono inferiori a 3,5 g/dl. Se si utilizzano i colloidi per il solo ripristino della pressione oncotica, possono essere somministrati alla velocità di 2 ml/kg/ora/ev/cri.
L’efficacia della fluidoterapia nel ripristinare un circolo può essere valutata anche misurando la pressione arteriosa. Le misurazioni migliori si ottengono con la misurazione della pressione arteriosa invasiva la quale prevede però il posizionamento di una catetere arterioso. Nei pazienti svegli e traumatizzati tale pratica risulta di difficile attuazione, perciò comunemente si ricorre alla misurazione della pressione arteriosa non invasiva applicando dei manicotti pneumatici alla base della coda o all’estremità degli arti. La pressione arteriosa, per assicurare una buona perfusione tessutale dovrebbe essere ≥ 80 mmHg (con un intervallo di 80-120 mmHg) se media (MAP) e ≥ di 100 mmHg se sistolica.
Quando si effettua una fluidoterapia aggressiva (alle dosi shock sopra indicate), durante l’infusione, è importante monitorare almeno i seguenti parametri della perfusione ogni 15 minuti: frequenza cardiaca (v.n.= cane 70-160 bpm, gatto 120-140 bpm), tempo di riempimento capillare (v.n.= < 2 secondi), colore delle mucose (roseo) e il polso (pieno). Quando i parametri sopra menzionati rientrano nella normalità la fluidoterapia può essere somministrata alla velocità di mantenimento (2 ml/kg/ora/ev). Nel gatto, i colloidi devono essere somministrati lentamente: 5 ml/kg/ev in boli di 15 minuti e ad effetto, anche in corso di fluidoterapia rianimatoria. I colloidi come il tetrastarch al 6% e il destrano 70 hanno una pressione oncotica (COP) lievemente maggiore di quella ematica (circa 30-40 mmHg), se somministrati in quantità opportune e ad una velocità corretta, riducono il rischio di edemi e favoriscono una più rapida espansione del volume circolante rispetto ai cristalloidi. Se somministrati in quantità eccessiva possono causare un aumento del tempo di sanguinamento per diluizione dei fattori della coagulazione. In corso di emorragia grave il sangue deve essere somministrato il più rapidamente possibile (sotto pressione positiva) fino a raggiungere un ematocrito ≥ 25%, quando si utilizza per una grave coagulopatia deve esser somministrato lentamente.
Sangue: si somministra quando l’ematocrito è inferiore al 20% o quando è responsabile di un distress respiratorio o si verifica una pericolosa riduzione della DO2. 20 ml/kg sangue innalzano l’ematocrito di circa il 10%. L’emoglobina dovrebbe essere compresa tra 7 e 8 g/dl; meglio se ≥ 9–10 g/dl con un ematocrito ≥ 25%. Il volume di sangue da trasfondere in corso di emotrasfusione si calcola con la seguente formula:
- Cane: kg x 85 x (Hct desiderato-Hct ricevente)/Hct donatore
- Gatto: kg x 60 x (Hct desiderato-Hct ricevente)/Hct donatore
Si possono distinguere tre tipi di fluidoterapia per ripristinare un circolo in corso di shock:
- rianimazione intravascolare rapida
- rianimazione con ipotensione
- rianimazione con obiettivi sopra-normali
La rianimazione intravascolare rapida è la fluidoterapia più utilizzata ed è indicata nei pazienti con un deficit circolatorio conseguente ad una perdita del volume circolante (ad es. conseguente a diarrea e vomito gravi). Vedi infusione.
La rianimazione con ipotensione è utilizzata nei seguenti casi:
- Emorragie intracavitarie
- Traumi cranici
- Contusioni polmonari
- Shock cardiogeno
- Insufficienza renale oligurica
L’obbiettivo di tale fluidoterapia è ripristinare i parametri della perfusione mantenendo la pressione arteriosa normale oppure al di sotto dei valori normali: MAP ≤ 80 mmHg. La fluidoterapia è somministrata a piccoli boli: cristalloidi: 10-20 ml kg/ev/15 minuti ad effetto, colloidi: 5 ml/kg/ev/15 minuti ad effetto. Dopo ogni bolo di fluidoterapia si controllano i parametri della perfusione se sono normali si interrompe la fluidoterapia di rianimazione e si passa a quella di mantenimento con soluzioni elettrolitiche bilanciate.
La rianimazione con obbiettivi sopra normali: in alcuni pazienti può essere necessario incrementare la DO2 fino a valori superiori a quelli normali, come ad esempio in corso di: Sirs (sindrome della risposta infiammatoria sistemica) e shock settico. In tali casi si somministrano i fluidi a dose shock (vedi sopra) fino a che i parametri della perfusione ed emodinamici sono ottimali.
Pompa. Per mantenere efficace la pompa miocardica è necessario ripristinare la gittata cardiaca e la perfusione periferica ripristinando un circolo efficace grazie ad una opportuna fluidoterapia, quando ciò non è sufficiente è possibile somministrare farmaci attivi sull’apparato cardiocircolatorio quali la dobutamina a 5-15 µg/kg/min/cri o la dopamina a 5-10 µg/kg/min/cri. Quando la contrattilità è compromessa da patologie cardiache che alterano il ritmo o l’inotropismo è necessario somministrare farmaci cardioattivi quali ad esempio l’atropina, i β-bloccanti (ad es atenololo) e i farmaci bloccanti i canali del sodio (ad es. lidocaina), del calcio (ad es. diltiazem, verapamil) o del potassio (ad es. amiodarone).
Le aritmie ipocinetiche quali i blocchi atrio-ventricolari, la sindrome del seno malato o il silenzio atriale possono essere trattati con atropina a 20-40 mcg/kg/im,ev e nei casi gravi anche con dobutamina in cri. Le aritmie ipercinetiche sopraventricolari, quali ad esempio la tachicardia sinusale, atriale, giunzionale o ortodromica reciprocante, la fibrillazione atriale e la flutter atriale possono essere trattate nell’urgenza con manovre vagali, o con verapamil 50 mcg/kg/ev in 2-3 min, dose massima 0,15 mg/kg, propanololo 0,1-0,3 mg/kg/ev/bolo nel cane e 40-60 mcg/kg/ev/bolo nel gatto, fenilefrina 5-10 mcg/kg/ev/bolo. Le aritmie ipercinetiche ventricolari quali ad esempio la tachicardia ventricolare sostenuta, la tachicardia ventricolare polimorfa, la tachicardia ventricolare bidirezionale, i complessi ventricolari prematuri e le alterazioni del tracciato riconosciute come R su T possono essere trattate con potassio cloruro la cui dose è in funzione dell’ipopotassiemia, lidocaina a 2-4-8 mg/kg/ev/bolo seguiti da 40-80 mcg/kg/ev/min/cri nel cane e 0,25-1 mg/kg/ev/bolo seguiti da 10-40 mcg/kg/min/cri nel gatto o amiodarone a 3-5 mg/kg/ev/bolo. L’utilizzo dei farmaci cardioattivi deve essere effettuato solo quando è diagnosticata l’emergenza cardiologica, viceversa è meglio procrastinare il trattamento dopo una visita specialista cardiologica.
Bibliografia
- Viganò F. Lo shock, In: Viganò F. ed Medicina d’urgenza e terapia intensiva del cane e del gatto, 1st ed. Milano: Masson/EV; 2004, pp.16.
- Boag AK, Hughes D. Assessment and treatment of perfusion abnormalities in the emergency patient. Vet Clin North Am Small Anim Pract. 2005 Mar;35 (2):319-42.
- Kou QY, Guan XD. Effect of ethyl pyruvate on indices of tissue oxygenation and perfusion in dogs with septic shock. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. 2008 Jan;20(1):34-6.
- Moore KE, Murtaugh RJ. Pathophysiologic characteristics of hypovolemic shock. Clin North Am Small Anim Pract. 2001 Nov;31(6):1115-28.
- Fantoni DT, Auler Junior JO, Futema F, et al. Intravenous administration of hypertonic sodium chloride solution with dextran or isotonic sodium chloride solution for treatment of septic shock secondary to pyometra in dogs. J Am Vet Med Assoc. 1999 Nov 1;215(9):1283-7.
- Yum, PeiK, Moran S, et al. A prospective randomized trial using blood volume analysis in addition to pulmonary artery catheter (PAC), compared to PAC alone, to guide shock resuscitation in critically ill surgical patient. Shock. 2010 Jan 12.
- Barros JM, Do Nascimento PJr, Marinello JL, The effect of 6% hydroxyethyl starch-hypertonic saline in resuscitation of dogs with hemorragic shock. Anesth Analg. 2010 Sep 14
- Schertel ER, Allen DS, Muir WW, et al. Evaluation of a hypertonic saline-dextran solution for treatment of dogs with shock induced by gastric dilatation-volvulus. J Am Vet Med Assoc. 1997 Jan 15;210(2):226-30.